解题方法
1 . 下列化学用语或表述正确的是
A.中子数为9的氮原子: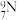 |
B. 的电子式: 的电子式: |
C. 的VSEPR模型: 的VSEPR模型: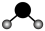 |
D.碳的基态原子价层电子的轨道表示: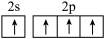 |
您最近半年使用:0次
2024-04-16更新
|
183次组卷
|
2卷引用:吉林省长春市2023-2024学年高三下学期质量监测(三)化学试题
名校
2 . 下列说法中,错误的是
A.氧原子可以形成 、 、 ,也可能形成 ,也可能形成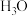 |
B. 中的 中的 原子的杂化方式为 原子的杂化方式为 ,空间结构为 ,空间结构为 形 形 |
C. 的分子结构是 的分子结构是 ,在 ,在 中有1个 中有1个 键和2个 键和2个 键 键 |
D. 的分子结构是 的分子结构是 ,在 ,在 中只有 中只有 键没有 键没有 键 键 |
您最近半年使用:0次
23-24高三上·天津和平·期末
解题方法
3 . 下列说法正确的是
A.基态氧原子价电子排布图: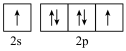 |
B.基态Cr原子电子排布式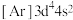 |
C. 的空间结构:平面三角形 的空间结构:平面三角形 |
D.冰中的氢键示意图: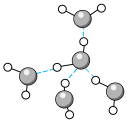 |
您最近半年使用:0次
23-24高三上·天津静海·阶段练习
名校
解题方法
4 . 下列有关化学用语表示正确的是
A.四氯化碳分子空间填充模型: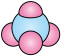 |
B.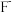 的离子结构示意图: 的离子结构示意图: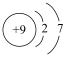 |
C.溴化铵的电子式: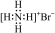 |
D. 的VSEPR模型为 的VSEPR模型为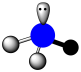 |
您最近半年使用:0次
解题方法
5 . 下列化学用语表述正确的是
A. 的空间结构为V形 的空间结构为V形 | B.顺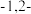 二溴乙烯结构式为 二溴乙烯结构式为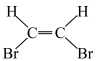 |
C. 的电子式为 的电子式为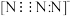 | D.基态 原子价电子排布式为 原子价电子排布式为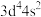 |
您最近半年使用:0次
名校
6 . Ⅰ.硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ ,基态S原子电子占据最高能级的电子云轮廓图为______ 形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是______ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______ 。
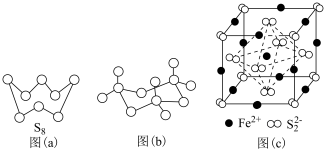
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______ 形,其中共价键的类型有______ 种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为______
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是______ 。
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是______ 。
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是______ 。
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为______ 。
(9)NH3、PH3、AsH3的沸点由高到低的顺序为______ (填化学式。下同)。还原性由强到弱的顺序为______ 。键角由大到小的顺序为______ 。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为
(9)NH3、PH3、AsH3的沸点由高到低的顺序为
您最近半年使用:0次
2024-01-15更新
|
144次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
7 . A、B、C、D为原子序数依次增大的四种元素,A2﹣和B+具有相同的电子构型:C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________ (填元素符号),其中C原子的核外电子排布式为 ___________ 。
(2)单质A有两种同素异形体,其中沸点高的是___________ (填分子式),原因是 ___________ ;B的氢化物的电子式为 ___________ 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为___________ ,中心原子的杂化轨道类型为 ___________ 。
(4)化合物D2A的立体构型为___________ ,中心原子的价层电子对数为 ___________ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为
(4)化合物D2A的立体构型为
您最近半年使用:0次
名校
8 . 部分含氯物质的分类与相应化合价的关系如图所示。下列推理错误的是
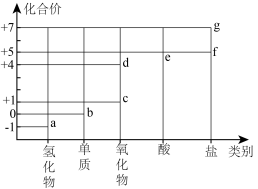

| A.a与e反应可生成b | B.d为酸性氧化物 |
| C.c溶于水可生成HClO | D.f、g中阴离子的VSEPR模型相同 |
您最近半年使用:0次
2023-12-16更新
|
181次组卷
|
4卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期12月月考化学试题
名校
9 . 下列表述不正确的是
A.离子化合物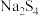 的电子式: 的电子式: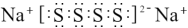 |
B. 空间结构为平面正三角形 空间结构为平面正三角形 |
C.等物质的量的 和 和 中σ键数之比为3∶2 中σ键数之比为3∶2 |
D. 不能作为配合物的配位体 不能作为配合物的配位体 |
您最近半年使用:0次
名校
解题方法
10 . 由H、C、O、N、S、Al、Fe、Ti等元素能形成多种物质。这些物质有许多用途。请回答下列问题:
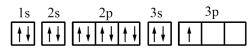
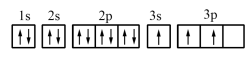
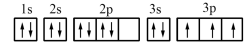
(1)某同学写出了铝原子的4种不同状态的电子排布图:
 .
.
 .
.
 .
.
 .
.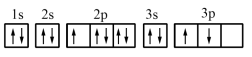
其中能量最低的是_______ (填字母)。
(2)C、O、N 原子的第一电离能由大到小的顺序为_______ ;H2S的键角比H2O的键角_______ (填“大”或“小”)
(3)铁能与三氮唑(结构见图甲)形成多种配合物。
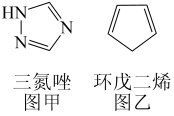
①l mol三氮唑中所含σ键的数目为_______ mol; 碳原子杂化方式是_______ ;
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是_______ 。
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:
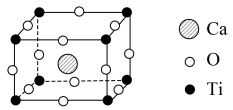
钙钛矿的化学式为_______ ,该晶胞中Ca2+与O2-的最短距离是_______ cm(已知晶胞参数为anm)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
 .
.
 .
.
 .
.
 .
.
其中能量最低的是
(2)C、O、N 原子的第一电离能由大到小的顺序为
(3)铁能与三氮唑(结构见图甲)形成多种配合物。

①l mol三氮唑中所含σ键的数目为
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:

钙钛矿的化学式为
您最近半年使用:0次
2023-08-27更新
|
69次组卷
|
2卷引用:吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高三上学期1月期末化学试题



