名校
1 . 下列说法中,错误的是
A.氧原子可以形成 、 、 ,也可能形成 ,也可能形成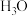 |
B. 中的 中的 原子的杂化方式为 原子的杂化方式为 ,空间结构为 ,空间结构为 形 形 |
C. 的分子结构是 的分子结构是 ,在 ,在 中有1个 中有1个 键和2个 键和2个 键 键 |
D. 的分子结构是 的分子结构是 ,在 ,在 中只有 中只有 键没有 键没有 键 键 |
您最近一年使用:0次
名校
解题方法
2 . 碳族元素中的Sn和氧族元素中的Te的有机化合物受到广泛关注。文献报道了利用有八面体结构的有机碲酸A与三甲基氯化锡B合成了一种具有抗癌活性的含碲和锡有机化合物C,反应前后Te和Sn的杂化方式不变。请回答下列问题:

(1)Te原子的最高能层理论上所具有的轨道数为_____ 。
(2)气态TeO3分子的立体构型为_____ ;共价化合物B中Sn的杂化方式为_____ 。化合物A中Te与下列化合物中S的杂化方式相同的是_____ (填序号)。
①H2S ②SO2③SO3④SF6
(3)用一个溴原子和一个氯原子取代有机碲酸A中与Te相连的两个羟基,结构仍为八面体,取代后的有机碲酸可能有_____ 种。
(4)有机化合物C核磁共振氢谱显示等效氢的个数比为_____ 。
(5)化合物B可以用SnI4合成,α-SnI4为立方晶体,其晶胞沿面对角线的投影如图所示:
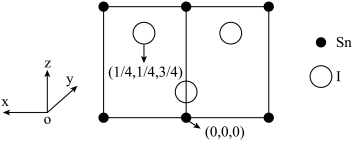
①晶胞中Sn和I之间的最近距离为apm,α-SnI4的密度的计算式为_____ g/cm3(设阿伏加德罗常数为NA);晶胞中由碘原子所围成的空隙中心坐标为_____ 。
②常温常压下SiF4为气态而SiCl4为液态,原因____ ,SnF4和SnCl4都为离子晶体,而SnF4为固体,SiCl4为液体,这是由于F到Cl的变化使得与Sn的卤化物中化学键的离子性____ 、共价性____ 。(填“增强”“不变”或“减弱”)

(1)Te原子的最高能层理论上所具有的轨道数为
(2)气态TeO3分子的立体构型为
①H2S ②SO2③SO3④SF6
(3)用一个溴原子和一个氯原子取代有机碲酸A中与Te相连的两个羟基,结构仍为八面体,取代后的有机碲酸可能有
(4)有机化合物C核磁共振氢谱显示等效氢的个数比为
(5)化合物B可以用SnI4合成,α-SnI4为立方晶体,其晶胞沿面对角线的投影如图所示:

①晶胞中Sn和I之间的最近距离为apm,α-SnI4的密度的计算式为
②常温常压下SiF4为气态而SiCl4为液态,原因
您最近一年使用:0次
解题方法
3 . 单质硼的硬度近似于金刚石,有很高的电阻。但它的导电率随温度的升高而增大,高温时为良导体。硼在自然界中主要以硼酸和硼酸盐的形式存在。
(1)基态硼原子的价电子排布式为_______ ,晶体硼的熔沸点_______ (填“高于”或“低于”)金刚石,原因是_______ 。
(2)硼酸与氢氧化钠在一定条件下可以生成四硼酸钠,结构如图所示,四硼酸钠中含有的化学键类型为_______ ,O原子的杂化类型为_______ ,B原子与相连的3个O原子围成的图形为_______ ,第一电离能介于硼元素和氧元素之间的第二周期元素有_______ 种。

(3)硼和氮可以构成多种类型的晶体,其中一种晶体的晶胞如图所示,晶胞上下底面均为菱形,晶胞参数如图所示,该晶体的化学式为_______ ,晶胞密度为_______ (写出表达式即可)。

(1)基态硼原子的价电子排布式为
(2)硼酸与氢氧化钠在一定条件下可以生成四硼酸钠,结构如图所示,四硼酸钠中含有的化学键类型为

(3)硼和氮可以构成多种类型的晶体,其中一种晶体的晶胞如图所示,晶胞上下底面均为菱形,晶胞参数如图所示,该晶体的化学式为

您最近一年使用:0次
名校
4 . 我国科学家最近开发了CO2/Mg潮湿环境二次电池,化学反应原理为2Mg+3CO2+2H2O=2MgCO3·H2O+C。下列说法错误的是
| A.MgCO3·H2O中阴离子的空间结构为三角锥形 |
| B.基态O原子核外有8种不同运动状态的电子 |
| C.H2O中氢、氧原子的个数比为2:1,体现了共价键的饱和性 |
| D.单质镁是由镁离子和自由电子构成的金属晶体 |
您最近一年使用:0次
2022-06-03更新
|
89次组卷
|
2卷引用:吉林省白山市抚松县第一中学2021-2022学年高二下学期第二次月考化学试题
名校
解题方法
5 . 下列关于共价键键参数的说法中正确的是
| A.双键的键能一定比单键的键能大 |
| B.BF3、NH3、H2S三种分子的键角依次减小 |
| C.CH4、P4均为正四面体形分子,键角相同 |
| D.CS2、C2H2、H2O2都是直线形分子 |
您最近一年使用:0次
6 . SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是
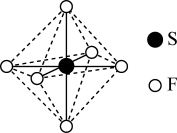
| A.是非极性分子 | B.键角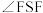 都等于90° 都等于90° |
C. 与 与 之间共用电子对偏向S 之间共用电子对偏向S | D. 原子满足8电子稳定结构 原子满足8电子稳定结构 |
您最近一年使用:0次
2021-10-23更新
|
8195次组卷
|
31卷引用:吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题
吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题2021年新高考海南化学高考真题2021年海南高考化学试题变式题1-10(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)福建省厦门市第一中学2021-2022学年高二下学期3月适应性练习化学试题辽宁省东北育才学校2021-2022学年高三上学期( 高中部) 第三次模拟考试化学试题(已下线)秘籍03 化学用语-备战2022年高考化学抢分秘籍(全国通用)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题福建省福州第一中学2021-2022学年高二下学期期中考试化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题50 分子的立体结构的判断-备战2023年高考化学一轮复习考点微专题(已下线)微专题51 极性、溶解性、手性、无机含氧酸酸性的判断-备战2023年高考化学一轮复习考点微专题(已下线)第30讲 分子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题辽宁省大石桥市第三高级中学2021-2022学年高三12月月考化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)巩固训练7(已下线)题型91 分子的极性与共价键的极性判断浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题广东省惠州市博罗县博师高级中学2022-2023学年高二下学期3月考试化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期期中考试化学试题(已下线)专题06 物质结构与性质(已下线)专题06 物质结构与性质(已下线)第21讲分子结构与性质(已下线)第4讲 空间构型(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)上海中学东校2023-2024学年高三上学期9月月考化学试题海南省文昌中学2023-2024学年高二下学期第一次月考化学试题广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题
名校
解题方法
7 . A、B、C、D 4种短周期元素,原子序数依次增大。其元素相关信息如下表。
(1)元素A、B、C中,电负性最大的是_______ (填元素符号)。
(2)A与B形成共价化合物 ,其分子的空间结构呈
,其分子的空间结构呈_______ 形。
(3) 易溶于
易溶于 中的原因是
中的原因是_______ 。
(4)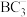 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为_______ ;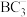 的空间结构为
的空间结构为_______ 。
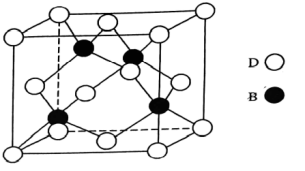
(5)B和D两种元素组成的化合物是共价晶体,其晶胞如下图所示,则表示该化合物的化学式为_______ (请用元素符号表示)。
| 元素 | 信息 |
| A | 元素原子的核外电子只有一种运动状态 |
| B | 价电子层中的未成对电子有3个 |
| C | 最外层电子数为其内层电子数的3倍 |
| D | 离子半径在同周期金属元素中最小 |
(1)元素A、B、C中,电负性最大的是
(2)A与B形成共价化合物
 ,其分子的空间结构呈
,其分子的空间结构呈(3)
 易溶于
易溶于 中的原因是
中的原因是(4)
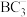 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为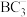 的空间结构为
的空间结构为(5)B和D两种元素组成的化合物是共价晶体,其晶胞如下图所示,则表示该化合物的化学式为

您最近一年使用:0次
2021-07-20更新
|
214次组卷
|
2卷引用:吉林省长春市第八中学2021-2022学年高二下学期线上月考化学试题
8 . 已知A、B、C、D、E代表五种元素。A元素的三价离子3d能级处于半充满;B元素原子的最外层电子数是内层电子总数的2倍;C的原子轨道中有2个未成对的电子,且与B可形成两种常见的气体;D的原子序数小于A,D与C可形成DC2和DC3两种分子,且DC2是极性分子,DC3是非极性分子;E是短周期元素中除了稀有气体外原子半径最大的元素。试回答下列问题:
(1)写出A元素基态原子的价层电子排布图___ 。
(2)B、C、D三种元素的电负性由大到小的顺序为___ (写元素符号)。
(3)E与C以1:1形成的物质的电子式为___ 。该物质与BC2反应的化学方程式为___ 。
(4)用电子式表示BC2形成过程___ 。
(5)E元素焰色反应的原因是___ 。
(6)用VSEPR理论判断DC3分子的空间立体结构为___ 。
(7)上述元素中第一电离能最大的元素是___ (填元素符号)。
(1)写出A元素基态原子的价层电子排布图
(2)B、C、D三种元素的电负性由大到小的顺序为
(3)E与C以1:1形成的物质的电子式为
(4)用电子式表示BC2形成过程
(5)E元素焰色反应的原因是
(6)用VSEPR理论判断DC3分子的空间立体结构为
(7)上述元素中第一电离能最大的元素是
您最近一年使用:0次
9 . 以下分子或离子的结构为正四面体形且键与键夹角为109°28′的是
①CH4 ②SiCl4 ③CH3Cl ④P4
①CH4 ②SiCl4 ③CH3Cl ④P4
| A.①②④ | B.①②③④ | C.①② | D.①③ |
您最近一年使用:0次



