1 . 我国科学家成功合成了世界上首个五氮阴离子盐,局部结构如图所示。其中含有两种10电子离子、一种18电子离子,W、X、Y、Z为原子序数依次增大的短周期元素,Z的单质可以用于自来水消毒,图中虚线表示氢键。下列说法正确的是
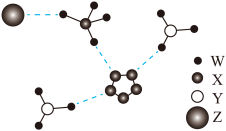
| A.五氮阴离子盐中两种阳离子的立体结构相同 |
| B.X、Y、Z对应的最简单氢化物中沸点最高的是X |
| C.Z的氧化物对应的水化物均为强酸 |
D.五氮阴离子盐中含有的大π键为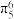 |
您最近一年使用:0次
名校
解题方法
2 . 下列化学用语或图示不正确的是
A.邻羟基苯甲酫分子内氢键: |
B. 水解的离子方程式: 水解的离子方程式: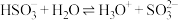 |
C. 分子中 分子中 键的形成: 键的形成: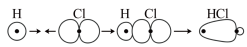 |
D. 的VSEPR模型: 的VSEPR模型: |
您最近一年使用:0次
7日内更新
|
275次组卷
|
2卷引用:吉林省长春市东北师范大学附属中学2024届高三下学期第五次模拟考试化学试题
名校
解题方法
3 . 铁及其化合物广泛地应用到各个领域。回答下列问题:
(1)铁元素位于元素周期表的___________ 区。
(2)我国菱铁矿 储量较为丰富,
储量较为丰富, 中
中 的空间结构为
的空间结构为___________ 。
(3)草酸亚铁可作为电池正极材料磷酸铁锂的原料,其结构简式如下,碳原子的杂化方式是___________ 。 溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成
溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成___________ 键。
(5)以 、
、 合成
合成 ,Fe是常用的催化剂。实际生产中采用铁的氧化物
,Fe是常用的催化剂。实际生产中采用铁的氧化物 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为___________ 。___________ 。若该晶体的密度是d g⋅cm ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为___________ nm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)铁元素位于元素周期表的
(2)我国菱铁矿
 储量较为丰富,
储量较为丰富, 中
中 的空间结构为
的空间结构为(3)草酸亚铁可作为电池正极材料磷酸铁锂的原料,其结构简式如下,碳原子的杂化方式是
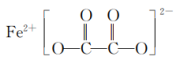
 溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成
溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成(5)以
 、
、 合成
合成 ,Fe是常用的催化剂。实际生产中采用铁的氧化物
,Fe是常用的催化剂。实际生产中采用铁的氧化物 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为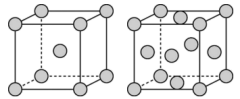
 ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。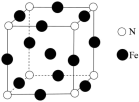
您最近一年使用:0次
名校
解题方法
4 . 下列化学用语或表述正确的是
A.HClO的电子式: |
B.中子数为9的氮原子: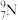 |
C.H2O的VSEPR模型: |
D.碳的基态原子的价层电子轨道表示式: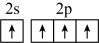 |
您最近一年使用:0次
2024-04-13更新
|
270次组卷
|
4卷引用:吉林省长春市2023-2024学年高三下学期质量监测(三)化学试题
吉林省长春市2023-2024学年高三下学期质量监测(三)化学试题(已下线)东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题东北三省四市2024届高三教研联合体高考模拟(一)化学试卷东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题
名校
5 . 下列说法中,错误的是
A.氧原子可以形成 、 、 ,也可能形成 ,也可能形成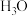 |
B. 中的 中的 原子的杂化方式为 原子的杂化方式为 ,空间结构为 ,空间结构为 形 形 |
C. 的分子结构是 的分子结构是 ,在 ,在 中有1个 中有1个 键和2个 键和2个 键 键 |
D. 的分子结构是 的分子结构是 ,在 ,在 中只有 中只有 键没有 键没有 键 键 |
您最近一年使用:0次
23-24高三上·天津静海·阶段练习
名校
解题方法
6 . 下列有关化学用语表示正确的是
A.四氯化碳分子空间填充模型: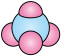 |
B.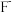 的离子结构示意图: 的离子结构示意图: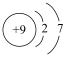 |
C.溴化铵的电子式: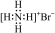 |
D. 的VSEPR模型为 的VSEPR模型为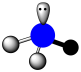 |
您最近一年使用:0次
名校
7 . Ⅰ.硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ ,基态S原子电子占据最高能级的电子云轮廓图为______ 形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是______ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______ 。
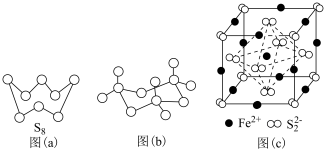
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______ 形,其中共价键的类型有______ 种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为______
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是______ 。
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是______ 。
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是______ 。
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为______ 。
(9)NH3、PH3、AsH3的沸点由高到低的顺序为______ (填化学式。下同)。还原性由强到弱的顺序为______ 。键角由大到小的顺序为______ 。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为
(9)NH3、PH3、AsH3的沸点由高到低的顺序为
您最近一年使用:0次
2024-01-15更新
|
149次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
8 . A、B、C、D为原子序数依次增大的四种元素,A2﹣和B+具有相同的电子构型:C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________ (填元素符号),其中C原子的核外电子排布式为 ___________ 。
(2)单质A有两种同素异形体,其中沸点高的是___________ (填分子式),原因是 ___________ ;B的氢化物的电子式为 ___________ 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为___________ ,中心原子的杂化轨道类型为 ___________ 。
(4)化合物D2A的立体构型为___________ ,中心原子的价层电子对数为 ___________ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为
(4)化合物D2A的立体构型为
您最近一年使用:0次
名校
9 . 部分含氯物质的分类与相应化合价的关系如图所示。下列推理错误的是
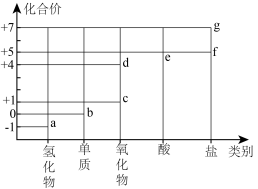

| A.a与e反应可生成b | B.d为酸性氧化物 |
| C.c溶于水可生成HClO | D.f、g中阴离子的VSEPR模型相同 |
您最近一年使用:0次
2023-12-16更新
|
183次组卷
|
4卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期12月月考化学试题
名校
10 . 下列表述不正确的是
A.离子化合物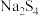 的电子式: 的电子式: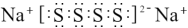 |
B. 空间结构为平面正三角形 空间结构为平面正三角形 |
C.等物质的量的 和 和 中σ键数之比为3∶2 中σ键数之比为3∶2 |
D. 不能作为配合物的配位体 不能作为配合物的配位体 |
您最近一年使用:0次



