1 . 我国科学家成功合成了世界上首个五氮阴离子盐,局部结构如图所示。其中含有两种10电子离子、一种18电子离子,W、X、Y、Z为原子序数依次增大的短周期元素,Z的单质可以用于自来水消毒,图中虚线表示氢键。下列说法正确的是
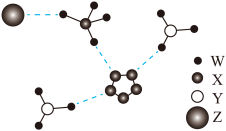
| A.五氮阴离子盐中两种阳离子的立体结构相同 |
| B.X、Y、Z对应的最简单氢化物中沸点最高的是X |
| C.Z的氧化物对应的水化物均为强酸 |
D.五氮阴离子盐中含有的大π键为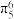 |
您最近一年使用:0次
真题
名校
2 . 下列化学用语或表述正确的是
| A.BeCl2的空间结构:V形 | B.P4中的共价键类型:非极性键 |
| C.基态Ni原子价电子排布式:3d10 | D.顺—2—丁烯的结构简式: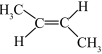 |
您最近一年使用:0次
2023-06-13更新
|
10796次组卷
|
13卷引用:吉林省吉林市第一中学2022-2023学年高一6月月考(线上)化学试题
吉林省吉林市第一中学2022-2023学年高一6月月考(线上)化学试题2023年高考辽宁卷化学真题(已下线)T2-化学用语(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)专题02 化学用语江西省乐安县第二中学2022-2023学年高二下学期6月期末考试化学试题(已下线)专题02 化学用语(已下线)专题02 化学用语(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题02 化学用语的正误判断-2023年高考化学真题题源解密(全国通用)(已下线)专题02 化学用语及其应用-2023年高考化学真题题源解密(新高考专用)(已下线)题型01 物质的组成与分类 传统文化 化学用语-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)测试辽宁化学 请勿下载
名校
3 . 下列说法正确的是
| A.非极性分子中的原子上一定不含孤电子对 |
| B.ABn型分子的中心原子最外层满足8电子稳定结构,则ABn不一定是非极性分子 |
| C.二氯甲烷(CH2Cl2)分子的中心原子采取sp3杂化,分子中键角均为109°28′ |
| D.平面三角形分子一定是非极性分子 |
您最近一年使用:0次
2023-01-13更新
|
187次组卷
|
3卷引用:吉林省吉林第一中学2022-2023学年高二上学期11月月考化学试题
吉林省吉林第一中学2022-2023学年高二上学期11月月考化学试题黑龙江省哈尔滨市第四中学校2022-2023学年高二下学期4月月考化学试题(已下线)第05讲 分子结构与物质的性质-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
名校
解题方法
4 . 某化合物的分子式为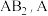 属
属 族元素,B属
族元素,B属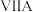 族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知
族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知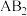 分子的键角为
分子的键角为 。下列推断不正确的是
。下列推断不正确的是
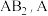 属
属 族元素,B属
族元素,B属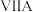 族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知
族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知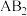 分子的键角为
分子的键角为 。下列推断不正确的是
。下列推断不正确的是A.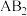 分子的空间构型为"V"形 分子的空间构型为"V"形 |
B.A-B键为极性共价键,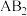 分子为非极性分子 分子为非极性分子 |
C.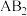 与 与 相比, 相比,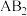 的熔点、沸点比 的熔点、沸点比 的低 的低 |
D.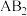 分子中无氢原子,分子间不能形成氢键,而 分子中无氢原子,分子间不能形成氢键,而 分子间能形成氢键 分子间能形成氢键 |
您最近一年使用:0次
2022-10-18更新
|
533次组卷
|
27卷引用:吉林省吉化第一高级中学校2021-2022学年高二上学期期末考试化学试题
吉林省吉化第一高级中学校2021-2022学年高二上学期期末考试化学试题2015-2016学年湖北省天门、仙桃、潜江市高二下学期期末化学试卷宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题贵州省习水县一中2018-2019学年高二上学期12月份月考化学试题贵州省息烽县一中2018-2019学年高二11月份考试化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题河南省林州市第一中学2019-2020学年高二4月月考(实验班)化学试题山西省晋中市平遥中学2019-2020高二下学期在线学习质量检测化学试题辽宁省大连市大连海湾高级中学2019-2020学年高二下学期第一次质量检测化学试题(已下线)河北省石家庄市第二中学2016-2017学年高二下学期3月份月考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 B素养拓展区(已下线)模块同步卷06 阶段性检测卷-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)黑龙江省大庆中学2020—2021学年高二下学期第一次月考化学试题山东省泰安市宁阳一中2020-2021学年高二下学期3月月考化学试题河北省石家庄市第二十三中学2021-2022学年高二下学期期中考试化学试题山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题第三节 分子结构与物质的性质 第2课时 分子间作用力 分子的手性四川省绵阳市盐亭中学2022-2023学年高二上学期第一次月考教学质量检测化学试题天津市耀华中学2022-2023学年高二上学期期末考试化学试题山东省乳山市银滩高级中学2022-2023学年高一下学期3月月考化学试题广东番禺中学2022-2023学年高二下学期科开学考试化学试题四川省广安市第二中学校2022-2023学年高二下学期期中考试化学试题河北省沧州市东光县等三县联考2022-2023学年高二下学期4月月考化学试题宁夏石嘴山市平罗中学2023-2024学年高二上学期第一次月考化学试题天津市朱唐庄中学2023-2024学年高二下学期3月检测化学试卷
名校
5 . 下列说法中不正确的是
| A.气体单质中,一定有σ键,可能有π键 |
| B.PCl5分子是非极性分子 |
| C.氢键键长一般定义为A-H…B的长度,而不是H…B的长度 |
D.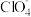 的VSEPR模型与离子的空间立体构型一致 的VSEPR模型与离子的空间立体构型一致 |
您最近一年使用:0次
2021-07-13更新
|
193次组卷
|
2卷引用:吉林省吉林市第一中学2022-2023学年高二上学期期末测试化学试题
名校
解题方法
6 . N、P、As都是VA族元素,且原子序数依次增大,它们的单质和化合物在生产、生活中有广泛应用。请回答下列相关问题。
(1)基态砷原子的价电子排布式为____ 。
(2)从结构分析硝酸符合形成氢键的条件但硝酸的沸点较低,其可能的原因是____ 。
(3) 与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。
与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。 离子的VSEPR模型名称为
离子的VSEPR模型名称为___ ,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是___ 。(用元素符号表示)
(4)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图1所示,在BP晶胞中B原子配位数是___ ,P原子占据的是B原子堆积的____ (选填“立方体”“正四面体”或“正八面体”)空隙。建立如图2所示坐标系,可得晶胞中A、C处原子的分数坐标,则M处的P原子分数坐标为____ ,若晶胞中B原子和P原子之间的最近核间距为a pm,则晶胞边长为____ cm。
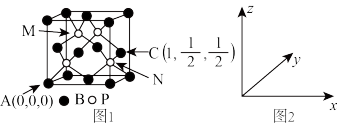
(1)基态砷原子的价电子排布式为
(2)从结构分析硝酸符合形成氢键的条件但硝酸的沸点较低,其可能的原因是
(3)
 与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。
与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。 离子的VSEPR模型名称为
离子的VSEPR模型名称为(4)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图1所示,在BP晶胞中B原子配位数是

您最近一年使用:0次
2021-03-26更新
|
385次组卷
|
2卷引用:吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题
7 . 表为周期表的一部分,其中的编号代表对应的元素。
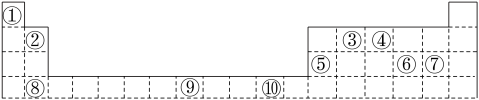
请回答下列问题:
(1)表中属于d区的元素是________ (填编号)。
(2)写出元素⑧的基态原子的电子排布式__________________________ 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为________ 对。
(4)元素④的氢化物的分子构型为________ ,中心原子的杂化形式为________ 。
(5)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表________ (填元素符号);其中电负性最大的是________ (填图中的序号)。

请回答下列问题:
(1)表中属于d区的元素是
(2)写出元素⑧的基态原子的电子排布式
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为
(4)元素④的氢化物的分子构型为

(5)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表
您最近一年使用:0次
解题方法
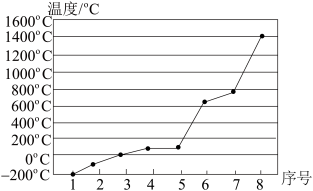
8 . A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大。A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图(D的氢化物沸点最高);F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式:____________ 。
(2)B、C、D三种元素电负性由大到小的顺序是____________ (用元素符号表示)。
(3)有关上述元素的下列说法,正确的是________ (填序号)。
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的立体构型为________ ,1 mol B2A4分子中含有________ 个σ键;

(1)写出F元素基态原子的核外电子排布式:
(2)B、C、D三种元素电负性由大到小的顺序是
(3)有关上述元素的下列说法,正确的是
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的立体构型为
您最近一年使用:0次
9-10高二下·辽宁大连·期末
真题
名校
9 . 用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
您最近一年使用:0次
2019-01-30更新
|
2687次组卷
|
77卷引用:吉林省舒兰市实验中学2019-2020学年高二下学期期中考试化学试题
吉林省舒兰市实验中学2019-2020学年高二下学期期中考试化学试题(已下线)09-10年辽宁大连23中高二下学期期末考试化学卷(已下线)09~10年宝鸡中学高二下学期期末考试化学卷(已下线)09—10年哈三中高二下学期期末考试化学卷2007年普通高等学校招生全国统一考试(海南卷)化学试题(已下线)2010-2011学年山东省兖州市高二下学期期中考试化学试卷(已下线)2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷(已下线)2011-2012学年福建省厦门六中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年江西省上饶县中学高二第一次月考化学试卷(已下线)2011-2012学年河南省偃师高中高二3月月考化学试卷(已下线)2011-2012年山东济南外国语学校高二下学期期中考试理科化学试卷(已下线)2011-2012学年吉林省长春外国语学校高二下学期期末考试化学试卷(已下线)2012-2013学年福建省福州文博中学高二上学期期末考试化学试卷(已下线)2012-2013学年福建三明泰宁一中高二下第一次阶段考试化学试卷(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(已下线)2012-2013学年辽宁省沈阳二中高二下学期期中考试化学试卷(已下线)2013-2014河北正定中学第二学期第一次月考高二化学试卷2014-2015黑龙江省哈尔滨六中高二上期末化学试卷2014-2015福建省四地六校高二下学期第一次联考化学试卷2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷2015-2016学年宁夏六盘山高中高二下学期期中化学试卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年内蒙古元平煤高中高二实验班下期中化学卷2015-2016学年河南省三门峡市灵宝一中高二下第一次月考化学试卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷(已下线)同步君 选修3 第二章 第二节 第一课时 价电子互斥理论2016-2017学年山东省滨州市高二下学期第一次阶段性测试化学试卷河北省蠡县中学2016-2017学年高二6月月考化学试题河北省廊坊市第一中学2016-2017学年高二下学期6月月考化学试题广西宾阳县宾阳中学2016-2017学年高二下学期7月期末考试化学试题福建省福州市八县(市)协作校2016-2017学年高二下学期期末考试化学试题陕西省宝鸡中学2016-2017学年高二下学期期末考试化学试题河北省定州中学2018届高三上学期高中毕业班第一次调研化学试题福建省福州市八县协作校2016-2017学年高二下学期期末化学试题高中化学人教版 选修三 第2章 分子结构与性质 价电子对互斥理论宁夏青铜峡市高级中学2017-2018学年高二上学期期末考试化学试题人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第1课时)河北省石家庄市鹿泉一中2017-2018学年高二3月月考化学试题贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题贵州省安顺市普定县第一中学2018-2019学年高二上学期12月考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二上学期期末考试化学试题福建省晋江市季延中学2018-2019学年高二下学期期中考试化学试题黑龙江省哈尔滨市阿城区第二中学2018-2019学年高二下学期期中考试化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题吉林省延边市长白山第一高级中学2019-2020学年高二下学期验收考试化学试卷山东省泰安市2020年高二下学期化学期中考试(鲁科版)新疆吐蕃市高昌区第二中学2019-2020学年高二下学期期末考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题吉林省长春市实验中学2019-2020高二下学期期中考试化学试题福建省龙岩市武平县第一中学2020-2021学年高二上学期10月月考化学试题四川省阿坝州九寨沟2019-2020学年高二上学期期末考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构(已下线)模块同步卷11 综合检测卷(基础卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)山西省晋中市新一双语学校2020-2021学年高二下学期3月月考化学试题山西省太原市2020-2021学年高二下学期期中质量监测理科化学试题吉林省长春市榆树高级中学2020-2021学年高二下学期期中考试化学试题福建省福州市金山中学2020-2021学年高二下期中考试化学试题海南省三亚华侨学校(南新校区)2020-2021学年高二下学期期中考试化学试题(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)宁夏吴忠中学2021-2022学年高三上学期第一次月考化学试题(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)宁夏青铜峡市宁朔中学2021-2022学年高二3月月考化学试题(已下线)专题14 分子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题黑龙江省友谊县高级中学2022-2023学年高二上学期期末考试(新教材)化学试题贵州省江口中学2022-2023学年高二下学期3月份月考化学试题陕西省西安市铁一中学2022-2023学年高二下学期4月期中考试化学试题四川省资阳中学2022-2023学年高二上学期期末考试化学试题黑龙江省哈尔滨市宾县第二中学2022-2023学年高二下学期第二次月考化学试题湖南省株洲市炎陵县第一中学等2校2022-2023学年高二下学期开学考试化学试题2.2.1分子空间结构的理论分析(课后)-鲁科版选择性必修2河南省周口市西华县第一高级中学2023-2024学年高二上学期月考化学试卷新疆阿克苏市实验中学2022-2023学年高二下学期第一次月考化学试题河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷山西省大同市浑源七中2023-2024学年高二下学期第一次月考化学试题辽宁省本溪市第一中学2023-2024学年高二上学期1月期末化学试题
10 . 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________ ,该元素的符号是__________ ;
(2)Y元素原子的价层电子的轨道表示式为________ ,该元素的名称是__________ ;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________ ;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________ ;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____ 。
(1)X元素原子基态时的电子排布式为
(2)Y元素原子的价层电子的轨道表示式为
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由
您最近一年使用:0次
2019-01-30更新
|
1006次组卷
|
15卷引用:2014-2015学年吉林省吉林市第一中学高二下期末化学试卷
2014-2015学年吉林省吉林市第一中学高二下期末化学试卷2009年普通高等学校招生统一考试理综试题化学部分(宁夏卷)2014-2015河北省邢台市第一中学高二12月月考化学试卷河北省蠡县中学2016-2017学年高二6月月考化学试题河北省廊坊市第一中学2016-2017学年高二下学期6月月考化学试题宁夏青铜峡市高级中学2018届高三上学期期中考试化学试题【全国百强校】宁夏银川唐徕回民中学2017-2018学年高二下学期期中考试化学试题云南省大关县一中2018-2019学年高二上学期12月考试化学试题云南省元江哈尼族彝族傣族自治县一中2018-2019学年高二上学期12月考试化学试题云南省盐津县第一中学2018-2019学年高二上学期12月份考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题云南省玉溪市元江县第一中学2018-2019学年高二下学期开学考试化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)山东省聊城市2019-2020学年高三化学一轮复习《物质结构与性质(》模拟测试安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题



