解题方法
1 . 锌电池具有成本低、安全性强、可循环使用等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法错误的是
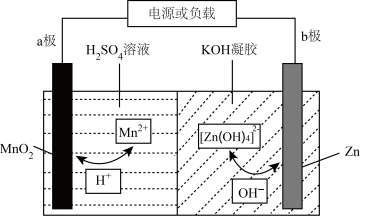
| A.充电过程中,b极接外接电源的负极 |
B.放电过程中,转移 时,b极消耗 时,b极消耗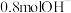 |
C.放电过程中,a极的电极反应式为 |
D.配离子 中Zn采用的是 中Zn采用的是 杂化,该配离子为空间四面体结构 杂化,该配离子为空间四面体结构 |
您最近半年使用:0次
名校
2 . 化学用语是化学专业语言,是学习化学的工具。下列有关化学用语的说法正确的是
A.顺-2-丁烯的结构简式: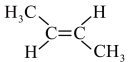 |
B.二氯化二硫 的电子式: 的电子式: 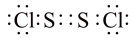 |
C.三氧化硫的空间填充模型: |
D.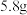 正丁烷和异丁烷的混合物中含有的极性键数目为 正丁烷和异丁烷的混合物中含有的极性键数目为 |
您最近半年使用:0次
解题方法
3 . “价-类二维图”是元素化合物知识学习的重要模型,下图是某短周期主族元素的“价-类二维图”,其最高化合价c与最低化合价a的代数和为4。
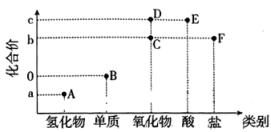
A.实验室可用 溶液吸收气体A 溶液吸收气体A |
| B.C分子的VSEPR模型为V形 |
| C.可用溴水检验F是否变质 |
| D.工业上通过B→D→E两步转化制备E |
您最近半年使用:0次
名校
4 . 氨气是一种重要的化工原料,极易溶于水,合成氨反应为N2(g)+3H2(g)=2NH3(g)  =-92.4kJ•mol-1。下列说法正确的是
=-92.4kJ•mol-1。下列说法正确的是
 =-92.4kJ•mol-1。下列说法正确的是
=-92.4kJ•mol-1。下列说法正确的是A.键角:H2O>NH3>NH |
B.相同浓度的氨水和 溶液中,水的电离程度相同 溶液中,水的电离程度相同 |
C.合成氨反应的 =E(N≡N)+3E(H-H)-6E(N-H)(E表示键能) =E(N≡N)+3E(H-H)-6E(N-H)(E表示键能) |
| D.1molN2与足量H2发生合成氨反应,放出的热量为92.4kJ |
您最近半年使用:0次
名校
解题方法
5 . 回答下列问题
(1)“棕色环”现象是检验溶液中 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入 ,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。
① 中N元素采取
中N元素采取________ 杂化,其立体构型为________ (填名称);
② 中一种配体实际上是
中一种配体实际上是 ,则其中Fe元素的化合价为
,则其中Fe元素的化合价为________ ;写出 的一种等电子体的化学式
的一种等电子体的化学式________ ;
③ 中微粒间不存在的作用力有
中微粒间不存在的作用力有________ ;
a.极性键 b.非极性键 c.σ键 d.π键 c.配位键 f.离子键
④ 与
与 等金属离子形成的配合物中配位原子一般是S而不是N,其原因是
等金属离子形成的配合物中配位原子一般是S而不是N,其原因是________ 。
(2)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子轨道表示式为________ ; 可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.
可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A. 、B.
、B. 、C.
、C. ,中间体
,中间体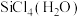 中Si采取的杂化类型为
中Si采取的杂化类型为________ (填字母)。________ ;
②分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为________ 。
(4)最简单的硼烷是 ,其分子结构如下左图,B原子的杂化方式为
,其分子结构如下左图,B原子的杂化方式为________ 。 ]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为
]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为________ 。 熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则
熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则 熔融的电离方程式为
熔融的电离方程式为________ 。
(1)“棕色环”现象是检验溶液中
 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入 ,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。①
 中N元素采取
中N元素采取②
 中一种配体实际上是
中一种配体实际上是 ,则其中Fe元素的化合价为
,则其中Fe元素的化合价为 的一种等电子体的化学式
的一种等电子体的化学式③
 中微粒间不存在的作用力有
中微粒间不存在的作用力有a.极性键 b.非极性键 c.σ键 d.π键 c.配位键 f.离子键
④
 与
与 等金属离子形成的配合物中配位原子一般是S而不是N,其原因是
等金属离子形成的配合物中配位原子一般是S而不是N,其原因是(2)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子轨道表示式为
 可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.
可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A. 、B.
、B. 、C.
、C. ,中间体
,中间体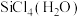 中Si采取的杂化类型为
中Si采取的杂化类型为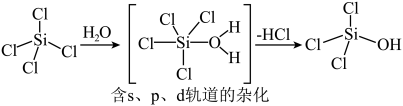
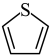
②分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为(4)最简单的硼烷是
 ,其分子结构如下左图,B原子的杂化方式为
,其分子结构如下左图,B原子的杂化方式为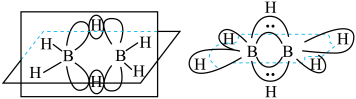
 ]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为
]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为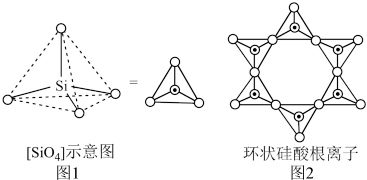
 熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则
熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则 熔融的电离方程式为
熔融的电离方程式为
您最近半年使用:0次
名校
6 . P原子在形成 分子时,
分子时,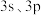 轨道和1个3d轨道参与形成
轨道和1个3d轨道参与形成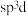 杂化,
杂化, 的空间构型为三角双锥形(如图所示)。下列关于
的空间构型为三角双锥形(如图所示)。下列关于 分子的说法不正确的是
分子的说法不正确的是
 分子时,
分子时,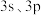 轨道和1个3d轨道参与形成
轨道和1个3d轨道参与形成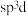 杂化,
杂化, 的空间构型为三角双锥形(如图所示)。下列关于
的空间构型为三角双锥形(如图所示)。下列关于 分子的说法不正确的是
分子的说法不正确的是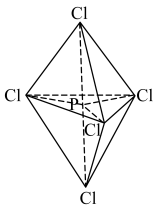
A. 分子中价层电子对数为5 分子中价层电子对数为5 | B. 分子中没有形成 分子中没有形成 键 键 |
C. 分子中所有 分子中所有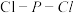 的键角都相等 的键角都相等 | D. 为非极性分子 为非极性分子 |
您最近半年使用:0次
名校
解题方法
7 . 氮及其化合物应用广泛。回答下列问题:
(1)基态N原子处于最高能级的电子云轮廓图为__________ 形。
(2)胍(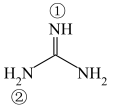 )为平面形分子,存在大π键
)为平面形分子,存在大π键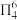 。胍属于
。胍属于__________ 分子(填“极性”或“非极性”),①号N原子H-N-C键角__________ ②号N原子H-N-C键角(填“>”“<”或“=”),胍易吸收空气中H2O和CO2,其原因是____________________________________ 。
(3)氮化钴属于立方晶系,经Cu掺杂得催化剂X,经Li掺杂得催化剂Y。
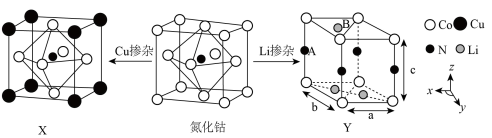
X属于立方晶系,晶胞参数为dpm,距离最近Co原子的核间距为__________ pm,Y属于六方晶系,晶胞参数为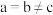 ,
, ,
,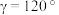 ,如A点原子的分数坐标为
,如A点原子的分数坐标为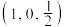 ,则B点Li原子的分数坐标为
,则B点Li原子的分数坐标为____________ ,1个N原子周围距离相等且最近的Li原子数目为_____________ 。
(1)基态N原子处于最高能级的电子云轮廓图为
(2)胍(
 )为平面形分子,存在大π键
)为平面形分子,存在大π键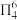 。胍属于
。胍属于(3)氮化钴属于立方晶系,经Cu掺杂得催化剂X,经Li掺杂得催化剂Y。

X属于立方晶系,晶胞参数为dpm,距离最近Co原子的核间距为
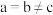 ,
, ,
,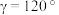 ,如A点原子的分数坐标为
,如A点原子的分数坐标为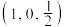 ,则B点Li原子的分数坐标为
,则B点Li原子的分数坐标为
您最近半年使用:0次
解题方法
8 . Ⅰ.MnS纳米粒子被广泛应用于除去重金属离子中的铬离子。
(1)锰的价层电子排布式为______ 。
(2)磁性氧化铁纳米粒子除铬效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-______ S2-(填“>”“<”或“=”)。H3O+中H—O—H的键角比H2O中的______ (填“大”或“小”)
(3)Mn可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为______ ,Mn与CO的C原子形成配位键,该配合物的配位数为______ ,配体NH3的空间结构为______ (用文字描述)。
Ⅱ.
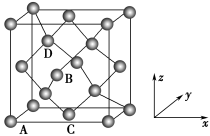
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为______ 。

(5)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为______ 。已知金刚石的晶胞参数为apm,则其密度为______ g·cm-3(列出计算式)。
(1)锰的价层电子排布式为
(2)磁性氧化铁纳米粒子除铬效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-
(3)Mn可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为
Ⅱ.
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为

(5)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
您最近半年使用:0次
9 . 我国在商代或更早就掌握了冶炼铜的技术。以黄铜矿为原料冶炼铜涉及多个反应,其中一个反应为 。
。
(1)基态 的电子排布式为
的电子排布式为___________ ,从原子结构角度上解释,高温下 能转化为
能转化为 的原因是
的原因是___________ 。铜、铁两类原子核外电子运动状态相差___________ 种。
(2) 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是___________
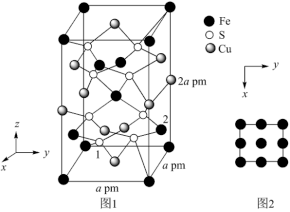
(3) 晶胞结构如图1所示。晶胞中
晶胞结构如图1所示。晶胞中 的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为(
的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为( ),则原子2的分数坐标为
),则原子2的分数坐标为___________ ;
 。
。(1)基态
 的电子排布式为
的电子排布式为 能转化为
能转化为 的原因是
的原因是(2)
 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是(3)
 晶胞结构如图1所示。晶胞中
晶胞结构如图1所示。晶胞中 的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为(
的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为( ),则原子2的分数坐标为
),则原子2的分数坐标为
您最近半年使用:0次
名校
解题方法
10 . 价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是
A. 和 和 的空间构型均为直线型 的空间构型均为直线型 | B. 和 和 的价层电子对互斥模型均为四面体 的价层电子对互斥模型均为四面体 |
C. 和 和 均为非极性分子 均为非极性分子 | D. 与 与 的键角相等 的键角相等 |
您最近半年使用:0次



