名校
解题方法
1 . 下列化学用语表达不正确的是
A.H2O的电子式: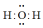 |
B.基态氧原子的轨道表示式: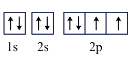 |
C.H2O中心原子的VSEPR模型: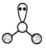 |
| D.H2O分子的空间结构:V形 |
您最近一年使用:0次
名校
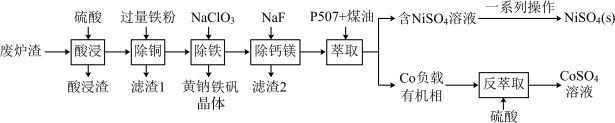
2 . 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)Co2+ 的价电子排布式________ , 空间构型为
空间构型为________
(2)提高“酸浸”速率的方法有_________ 。(任写一条)
(3)“滤渣1”的主要成分是_________ 。(写化学式)
(4)黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(5)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是________ (结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F- )最小为______ mol·L-1(已知离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全,Ksp(CaF2)=1.0 ×10-10,Ksp(MgF2)=7.5×10-11)。
(6)获得NiSO4(s)的“一系列操作”是________ 。
(7)工艺流程中,可循环利用的物质是___________ 。
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)Co2+ 的价电子排布式
 空间构型为
空间构型为(2)提高“酸浸”速率的方法有
(3)“滤渣1”的主要成分是
(4)黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12,“除铁”的离子方程式为
(5)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(6)获得NiSO4(s)的“一系列操作”是
(7)工艺流程中,可循环利用的物质是
您最近一年使用:0次
名校
解题方法
3 . 实验室中利用如图装置(部分装置省略)制备 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
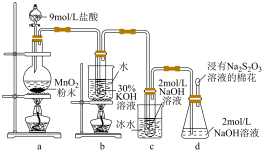
(1)盛放9mol/L盐酸的仪器名称是_______ 。
(2)b中发生化学反应的离子方程式是_______ 。
(3)d中浸有 溶液的棉花的作用是
溶液的棉花的作用是_______ 。
(4)下列相关说法不正确的是_______(填标号)。
(5)当b中试管内溶液由黄色变为无色时,反应到达终点。实际操作时,发现溶液由黄色变为紫红色甚至产生棕色沉淀影响产品纯度。针对该现象,可能混入的物质是_______ 。
(6)取少量 和NaClO溶液分别置于1号和2号试管中,滴加
和NaClO溶液分别置于1号和2号试管中,滴加 溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下
溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下 的氧化能力小于NaClO
的氧化能力小于NaClO_______ 。(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、 溶液)
溶液)
(7) 中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
_______  (填“>”或“<”)。
(填“>”或“<”)。
 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
(1)盛放9mol/L盐酸的仪器名称是
(2)b中发生化学反应的离子方程式是
(3)d中浸有
 溶液的棉花的作用是
溶液的棉花的作用是(4)下列相关说法不正确的是_______(填标号)。
| A.使用选择9mol/L盐酸替换浓盐酸,有利于减少HCl挥发 |
| B.控制液体滴加速率以维持氯气气流稳定,有利于减少反应过程倒吸的可能 |
C.反应结束后,b中液体经冷却结晶、过滤、冷水洗涤、干燥,可得 晶体 晶体 |
| D.增大装置c中NaOH溶液的浓度,有利于提高NaClO产率 |
(5)当b中试管内溶液由黄色变为无色时,反应到达终点。实际操作时,发现溶液由黄色变为紫红色甚至产生棕色沉淀影响产品纯度。针对该现象,可能混入的物质是
(6)取少量
 和NaClO溶液分别置于1号和2号试管中,滴加
和NaClO溶液分别置于1号和2号试管中,滴加 溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下
溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下 的氧化能力小于NaClO
的氧化能力小于NaClO 溶液)
溶液)(7)
 中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
解题方法
4 . 四种短周期主族元素在元素周期表中的相对位置如图所示,且X、Y、Z和Q四种元素的p轨道电子总数为24。化学家鲍林以Y的电负性作为参照标准,得出了各元素的电负性。下列叙述错误的是
| X | Y | |||
| Z | Q |
| A.最简单氢化物的稳定性:Y>Q>Z |
B. 分子中每个原子最外层都达到8电子稳定结构 分子中每个原子最外层都达到8电子稳定结构 |
| C.最高价氧化物对应水化物的酸性: Z<Q |
D.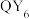 分子呈正八面体形 分子呈正八面体形 |
您最近一年使用:0次
2023-10-28更新
|
336次组卷
|
2卷引用:福建省宁德市部分达标学校2023-2024学年高三上学期期中考试化学试题
解题方法
5 . 下列有关分子的结构和性质的说法正确的是
| A.H2O2和C2H2均为直线形的非极性分子 |
B. 和 和 的空间结构均为平面三角形 的空间结构均为平面三角形 |
| C.邻羟基苯甲酸沸点比对羟基苯甲酸沸点高 |
| D.H2S和NH3均是极性分子,且H2S分子的键角较小 |
您最近一年使用:0次
6 . 下列化学用语或图示表达正确的是
A. 的电子式为 的电子式为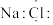 | B. 的VSEPR模型为 的VSEPR模型为 |
C.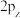 电子云图为 电子云图为 | D.基态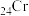 原子的价层电子轨道表示式为 原子的价层电子轨道表示式为 |
您最近一年使用:0次
2023-06-28更新
|
7109次组卷
|
16卷引用:福建省福建师范大学附属中学2023-2024学年高三上学期开学考化学试题
福建省福建师范大学附属中学2023-2024学年高三上学期开学考化学试题2023年高考北京卷化学真题(已下线)2023年北京卷高考真题变式题(选择题1-5)(已下线)第21讲分子结构与性质江西省吉安市宁冈中学2023-2024学年高三上学期开学考试化学试题(已下线)专题02 化学用语及其应用-2023年高考化学真题题源解密(新高考专用)新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题北京市第一七一中学2023-2024学年高三上学期10月考化学试题北京师范大学第二附属中学2023-2024学年高二上学期12月月考化学试题 北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题(已下线)题型01 物质的组成与分类 传统文化 化学用语-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷广东省珠海市第三中学2023-2024学年高二下学期3月月考化学试卷北京市第五十五中学2023-2024学年高二下学期(等级考)3月调研化学试卷海南省文昌中学2023-2024学年高二下学期第一次月考化学试题上海市华东师范大学第二附属中学(紫竹校区)2023-2024学年高三下学期三模考试 化学试题
7 . 以下哪个说法是正确的
| A.同核双原子分子的分子轨道,如果对于分子中心反对称,那么是反键轨道 |
| B.杂化轨道是体系几何构型的反映,它不是真实存在的 |
| C.分子的几何构型可通过计算中心原子的价层电子对数来判断 |
D.根据电子云的重叠形式可以把共价键分成 和 和 成键形式 成键形式 |
您最近一年使用:0次
解题方法
8 . 硼单质及其化合物在生产生活中应用广泛。
(1)离子液体是指室温或接近室温时呈液态,而本身由阴、阳离子构成的化合物,被认为是21世纪理想的绿色溶剂。氯代1-丁基-3-甲基咪唑离子液([bmim]Cl)可以与NH4BF4发生离子交换反应合成离子液体([bmim]BF4),如图所示:

①第二周期中第一电离能介于B与N之间的元素有______ 种;NH4BF4中N原子的杂化方式为______ ,BF 的立体构型为
的立体构型为______ 。
②已知分子或离子中的大π键可以用π 表示,其中m表示参与形成大π键的原子数,n表示大π键中的电子数,则[bmim]+中的大π键可以表示为
表示,其中m表示参与形成大π键的原子数,n表示大π键中的电子数,则[bmim]+中的大π键可以表示为_______ 。
(2)硼酸(H3BO3)是极弱的一元酸,如图为H3BO3晶体的片层结构,同一层内硼酸分子间通过_____ 相结合,层与层之间通过______ 相结合。H3BO3在热水中比冷水中溶解度显著增大的主要原因是______ 。

(3)一种新型轻质储氢材料的晶胞结构如图所示:
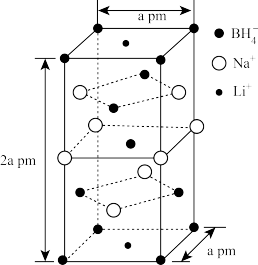
①该化合物的化学式为______ 。
②设阿伏加德罗常数的值为NA,则晶胞的密度为ρ=______ g•cm-3(用含a、NA的代数式表示)。
(1)离子液体是指室温或接近室温时呈液态,而本身由阴、阳离子构成的化合物,被认为是21世纪理想的绿色溶剂。氯代1-丁基-3-甲基咪唑离子液([bmim]Cl)可以与NH4BF4发生离子交换反应合成离子液体([bmim]BF4),如图所示:

①第二周期中第一电离能介于B与N之间的元素有
 的立体构型为
的立体构型为②已知分子或离子中的大π键可以用π
 表示,其中m表示参与形成大π键的原子数,n表示大π键中的电子数,则[bmim]+中的大π键可以表示为
表示,其中m表示参与形成大π键的原子数,n表示大π键中的电子数,则[bmim]+中的大π键可以表示为(2)硼酸(H3BO3)是极弱的一元酸,如图为H3BO3晶体的片层结构,同一层内硼酸分子间通过

(3)一种新型轻质储氢材料的晶胞结构如图所示:

①该化合物的化学式为
②设阿伏加德罗常数的值为NA,则晶胞的密度为ρ=
您最近一年使用:0次
名校
解题方法
9 . 下列化学用语表示不正确的是
A. 的价层电子对互斥模型: 的价层电子对互斥模型: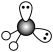 |
B.用原子轨道描述氯化氢分子中化学键的形成: |
C.基态C原子的价层电子轨道表示式: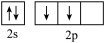 |
D. 的电子式: 的电子式: |
您最近一年使用:0次
2023-05-03更新
|
208次组卷
|
2卷引用:福建省宁德市一级达标校五校联合体2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
10 . 回答下列问题
(1)对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应键角如图所示。
的空间结构和相应键角如图所示。

 的VSEPR模型为
的VSEPR模型为_______ ; 的沸点比
的沸点比 的
的_______ (填写“高”或“低”),原因是_______ ; 的键角小于
的键角小于 的键角,原因是
的键角,原因是_______ 。
(3) 和NaClO均可作化工生产的氧化剂或氯化剂。制备
和NaClO均可作化工生产的氧化剂或氯化剂。制备 的反应为
的反应为 。
。
①上述方程式中涉及的非金属元素电负性由大到小的顺序是_______ (用元素符号表示)。
②常温时 是一种易溶于
是一种易溶于 的液体,则
的液体,则 分子属于
分子属于_______ 分子(填“极性”或“非极性”)。
③配合物 中心离子
中心离子 的配位数为6,向含
的配位数为6,向含 的溶液中滴加
的溶液中滴加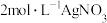 溶液,反应完全后共消耗
溶液,反应完全后共消耗 溶液
溶液 ,则该配合物的化学式为
,则该配合物的化学式为_______ 。
(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应键角如图所示。
的空间结构和相应键角如图所示。
 的VSEPR模型为
的VSEPR模型为 的沸点比
的沸点比 的
的 的键角小于
的键角小于 的键角,原因是
的键角,原因是(3)
 和NaClO均可作化工生产的氧化剂或氯化剂。制备
和NaClO均可作化工生产的氧化剂或氯化剂。制备 的反应为
的反应为 。
。①上述方程式中涉及的非金属元素电负性由大到小的顺序是
②常温时
 是一种易溶于
是一种易溶于 的液体,则
的液体,则 分子属于
分子属于③配合物
 中心离子
中心离子 的配位数为6,向含
的配位数为6,向含 的溶液中滴加
的溶液中滴加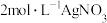 溶液,反应完全后共消耗
溶液,反应完全后共消耗 溶液
溶液 ,则该配合物的化学式为
,则该配合物的化学式为
您最近一年使用:0次



