解题方法
1 .  汽车尾气处理系统的原理是利用
汽车尾气处理系统的原理是利用 脱除
脱除 并转化为
并转化为 。
。
(1)已知在25℃, 时:
时:
反应ⅰ: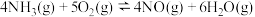

反应ⅱ: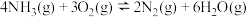
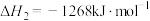
反应ⅲ:

________ 
(2)当 与
与 的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为
的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为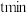 ,
, 的脱除率随温度变化的曲线如下图所示:
的脱除率随温度变化的曲线如下图所示: 与
与 的物质的量之比为
的物质的量之比为________ 。
②若曲线a中 的起始浓度为
的起始浓度为 ,则在900℃时
,则在900℃时 的脱除速率为
的脱除速率为________  。
。
③在800℃~1100℃时,催化剂活性较稳定。则 脱除的最佳温度为
脱除的最佳温度为________ ℃, 的脱除率在最佳温度之前逐渐增大的原因是
的脱除率在最佳温度之前逐渐增大的原因是________ 。
④940℃时,反应ⅲ的平衡常数
________ (用物质的量分数代替浓度,列计算式)。
⑤若其它条件不变,提高催化剂的活性,940℃时 的脱除率
的脱除率________ (选填“增大”“减小”或“不变”)。
(3)一定比例的 和
和 也能很好的脱除
也能很好的脱除 ,某催化反应机理如下图所示:
,某催化反应机理如下图所示: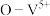 表示V化合价为
表示V化合价为 价,其它相似)
价,其它相似)
①该反应的催化剂为________ 。
② 转化为
转化为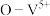 过程中
过程中 与
与 的物质的量比为
的物质的量比为________ 。
③ 转化为
转化为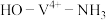 ,
, 键角增大的原因是
键角增大的原因是________ 。
 汽车尾气处理系统的原理是利用
汽车尾气处理系统的原理是利用 脱除
脱除 并转化为
并转化为 。
。(1)已知在25℃,
 时:
时:反应ⅰ:
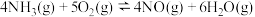

反应ⅱ:
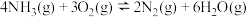
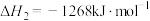
反应ⅲ:



(2)当
 与
与 的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为
的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为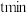 ,
, 的脱除率随温度变化的曲线如下图所示:
的脱除率随温度变化的曲线如下图所示:
 与
与 的物质的量之比为
的物质的量之比为②若曲线a中
 的起始浓度为
的起始浓度为 ,则在900℃时
,则在900℃时 的脱除速率为
的脱除速率为 。
。③在800℃~1100℃时,催化剂活性较稳定。则
 脱除的最佳温度为
脱除的最佳温度为 的脱除率在最佳温度之前逐渐增大的原因是
的脱除率在最佳温度之前逐渐增大的原因是④940℃时,反应ⅲ的平衡常数

⑤若其它条件不变,提高催化剂的活性,940℃时
 的脱除率
的脱除率(3)一定比例的
 和
和 也能很好的脱除
也能很好的脱除 ,某催化反应机理如下图所示:
,某催化反应机理如下图所示:
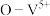 表示V化合价为
表示V化合价为 价,其它相似)
价,其它相似)①该反应的催化剂为
②
 转化为
转化为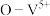 过程中
过程中 与
与 的物质的量比为
的物质的量比为③
 转化为
转化为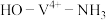 ,
, 键角增大的原因是
键角增大的原因是
您最近一年使用:0次
解题方法
2 . 碳酸氢钠溶液中碳酸氢根离子以氢键相连成二聚离子,其结构如图所示。
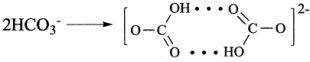
A.键能: | B. 的空间结构:平面三角形 的空间结构:平面三角形 |
C.溶解度: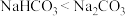 | D. 形成 形成 发生了化学反应 发生了化学反应 |
您最近一年使用:0次
7日内更新
|
77次组卷
|
2卷引用:福建省泉州中远学校2024届高三下学期5月模拟化学试题
解题方法
3 . 锌电池具有成本低、安全性强、可循环使用等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法错误的是
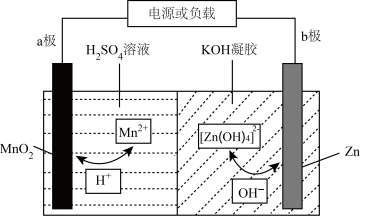
| A.充电过程中,b极接外接电源的负极 |
B.放电过程中,转移 时,b极消耗 时,b极消耗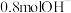 |
C.放电过程中,a极的电极反应式为 |
D.配离子 中Zn采用的是 中Zn采用的是 杂化,该配离子为空间四面体结构 杂化,该配离子为空间四面体结构 |
您最近一年使用:0次
名校
4 . 化学用语是化学专业语言,是学习化学的工具。下列有关化学用语的说法正确的是
A.顺-2-丁烯的结构简式: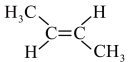 |
B.二氯化二硫 的电子式: 的电子式: 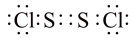 |
C.三氧化硫的空间填充模型: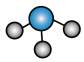 |
D.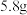 正丁烷和异丁烷的混合物中含有的极性键数目为 正丁烷和异丁烷的混合物中含有的极性键数目为 |
您最近一年使用:0次
解题方法
5 . “价-类二维图”是元素化合物知识学习的重要模型,下图是某短周期主族元素的“价-类二维图”,其最高化合价c与最低化合价a的代数和为4。
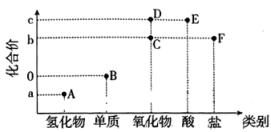
A.实验室可用 溶液吸收气体A 溶液吸收气体A |
| B.C分子的VSEPR模型为V形 |
| C.可用溴水检验F是否变质 |
| D.工业上通过B→D→E两步转化制备E |
您最近一年使用:0次
6 . 我国在商代或更早就掌握了冶炼铜的技术。以黄铜矿为原料冶炼铜涉及多个反应,其中一个反应为 。
。
(1)基态 的电子排布式为
的电子排布式为___________ ,从原子结构角度上解释,高温下 能转化为
能转化为 的原因是
的原因是___________ 。铜、铁两类原子核外电子运动状态相差___________ 种。
(2) 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是___________
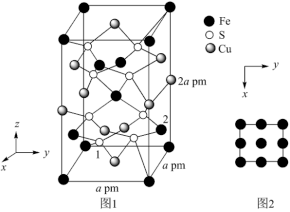
(3) 晶胞结构如图1所示。晶胞中
晶胞结构如图1所示。晶胞中 的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为(
的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为( ),则原子2的分数坐标为
),则原子2的分数坐标为___________ ;
 。
。(1)基态
 的电子排布式为
的电子排布式为 能转化为
能转化为 的原因是
的原因是(2)
 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是(3)
 晶胞结构如图1所示。晶胞中
晶胞结构如图1所示。晶胞中 的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为(
的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为( ),则原子2的分数坐标为
),则原子2的分数坐标为
您最近一年使用:0次
7 . 一种金属有机框架材料的化学式为 ,其结构如图。X、Y、Z、M为原子序数依次增大的1~36号元素,其中X、Z位于不同周期,四种元素中Y的第一电离能最大,
,其结构如图。X、Y、Z、M为原子序数依次增大的1~36号元素,其中X、Z位于不同周期,四种元素中Y的第一电离能最大, 的d轨道全充满。下列说法正确的是
的d轨道全充满。下列说法正确的是
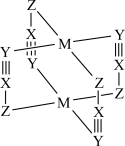
 ,其结构如图。X、Y、Z、M为原子序数依次增大的1~36号元素,其中X、Z位于不同周期,四种元素中Y的第一电离能最大,
,其结构如图。X、Y、Z、M为原子序数依次增大的1~36号元素,其中X、Z位于不同周期,四种元素中Y的第一电离能最大, 的d轨道全充满。下列说法正确的是
的d轨道全充满。下列说法正确的是
A.键角: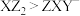 | B.最简单氢化物沸点:Z>Y>X |
| C.电负性:X>Y>M | D.最高价氧化物对应水化物酸性:Z>X |
您最近一年使用:0次
2024-02-03更新
|
182次组卷
|
3卷引用:福建省龙岩市2023-2024学年高三上学期期末考试化学试题
名校
解题方法
8 . 铼(Re)是生产飞机发动机叶片必不可少的材料。X、Y、Z、Q、W是原子序数依次增大且位于不同主族的短周期元素,其中X、Y、Z三种元素可与铼元素组成一种化合物(结构如图),该化合物与X的单质反应可得到铼。Q是地壳中含量最丰富的金属元素,Z与W形成的化合物为共价晶体。下列说法不正确的是
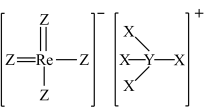
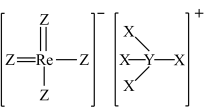
A.元素第一电离能: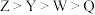 |
B.图中的阳离子与 互为等电子体,具有相同的空间结构 互为等电子体,具有相同的空间结构 |
| C.Q的最高价氧化物对应水化物可以和强碱反应 |
| D.熔点:W晶体小于W、Y形成的晶体 |
您最近一年使用:0次
2024-01-24更新
|
167次组卷
|
2卷引用:福建省三明第一中学2023-2024学年高三上学期12月月考化学试题
名校
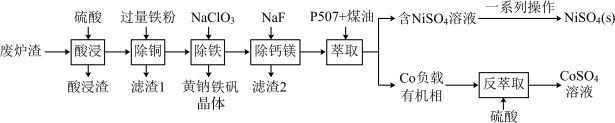
9 . 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)Co2+ 的价电子排布式________ , 空间构型为
空间构型为________
(2)提高“酸浸”速率的方法有_________ 。(任写一条)
(3)“滤渣1”的主要成分是_________ 。(写化学式)
(4)黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(5)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是________ (结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F- )最小为______ mol·L-1(已知离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全,Ksp(CaF2)=1.0 ×10-10,Ksp(MgF2)=7.5×10-11)。
(6)获得NiSO4(s)的“一系列操作”是________ 。
(7)工艺流程中,可循环利用的物质是___________ 。
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)Co2+ 的价电子排布式
 空间构型为
空间构型为(2)提高“酸浸”速率的方法有
(3)“滤渣1”的主要成分是
(4)黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12,“除铁”的离子方程式为
(5)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(6)获得NiSO4(s)的“一系列操作”是
(7)工艺流程中,可循环利用的物质是
您最近一年使用:0次
名校
解题方法
10 . 实验室中利用如图装置(部分装置省略)制备 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
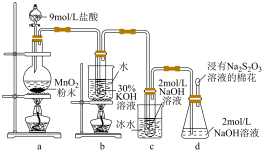
(1)盛放9mol/L盐酸的仪器名称是_______ 。
(2)b中发生化学反应的离子方程式是_______ 。
(3)d中浸有 溶液的棉花的作用是
溶液的棉花的作用是_______ 。
(4)下列相关说法不正确的是_______(填标号)。
(5)当b中试管内溶液由黄色变为无色时,反应到达终点。实际操作时,发现溶液由黄色变为紫红色甚至产生棕色沉淀影响产品纯度。针对该现象,可能混入的物质是_______ 。
(6)取少量 和NaClO溶液分别置于1号和2号试管中,滴加
和NaClO溶液分别置于1号和2号试管中,滴加 溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下
溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下 的氧化能力小于NaClO
的氧化能力小于NaClO_______ 。(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、 溶液)
溶液)
(7) 中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
_______  (填“>”或“<”)。
(填“>”或“<”)。
 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
(1)盛放9mol/L盐酸的仪器名称是
(2)b中发生化学反应的离子方程式是
(3)d中浸有
 溶液的棉花的作用是
溶液的棉花的作用是(4)下列相关说法不正确的是_______(填标号)。
| A.使用选择9mol/L盐酸替换浓盐酸,有利于减少HCl挥发 |
| B.控制液体滴加速率以维持氯气气流稳定,有利于减少反应过程倒吸的可能 |
C.反应结束后,b中液体经冷却结晶、过滤、冷水洗涤、干燥,可得 晶体 晶体 |
| D.增大装置c中NaOH溶液的浓度,有利于提高NaClO产率 |
(5)当b中试管内溶液由黄色变为无色时,反应到达终点。实际操作时,发现溶液由黄色变为紫红色甚至产生棕色沉淀影响产品纯度。针对该现象,可能混入的物质是
(6)取少量
 和NaClO溶液分别置于1号和2号试管中,滴加
和NaClO溶液分别置于1号和2号试管中,滴加 溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下
溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下 的氧化能力小于NaClO
的氧化能力小于NaClO 溶液)
溶液)(7)
 中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次



