名校
1 . 已知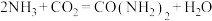 ,该反应可以生成常见肥料尿素,下列说法正确的是
,该反应可以生成常见肥料尿素,下列说法正确的是
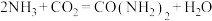 ,该反应可以生成常见肥料尿素,下列说法正确的是
,该反应可以生成常见肥料尿素,下列说法正确的是| A.在反应过程中有共价键的破坏和离子键的形成 | B. 有孤电子对,可做配体 有孤电子对,可做配体 |
C. 键的键长比 键的键长比 键短 键短 | D. 中的 中的 键和 键和 键数量比为1∶1 键数量比为1∶1 |
您最近一年使用:0次
名校
解题方法
2 . 氮族、氧族、卤族等在生活生产中都有重要应用。回答下列问题:
(1)NH3分子的VSEPR模型名称为___________ 。配合物 中的H—N—H的键角与游离的
中的H—N—H的键角与游离的 分子的键角比较,前者
分子的键角比较,前者_____ 后者(填“大于”“小于”或“相同”),其原因是___________ 。
(2)已知斥力大小:孤电子对-孤电子对>孤电子对-成键电子对,预测 离子的空间结构为
离子的空间结构为___________ 。
(3)①离子液体优异性能不断被开发利用。常见的离子液体含有如图中的离子等,已知微粒中的大 键可以用
键可以用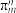 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则阳离子中的大
键中的电子数,则阳离子中的大 键可以表示为
键可以表示为___________ 。为了使正离子以单体形式存在以获得良好的溶解性能,与N原子相连的 不能被H原子替换,请解释原因:
不能被H原子替换,请解释原因:___________ 。
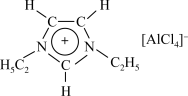
② 也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出
也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出 的结构式
的结构式___________ 。
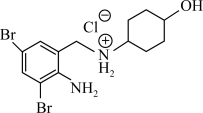
(4)为提高含氮碱性有机药物的水溶性,常用它们的盐酸盐。例如盐酸氨溴索(结构见如图)的阳离子可与水形成氢键,这些氢键表示式为O—H∙∙∙O(H2O)、___________ ,这种盐中C原子的杂化轨道的类型为___________ 。
(1)NH3分子的VSEPR模型名称为
 中的H—N—H的键角与游离的
中的H—N—H的键角与游离的 分子的键角比较,前者
分子的键角比较,前者(2)已知斥力大小:孤电子对-孤电子对>孤电子对-成键电子对,预测
 离子的空间结构为
离子的空间结构为(3)①离子液体优异性能不断被开发利用。常见的离子液体含有如图中的离子等,已知微粒中的大
 键可以用
键可以用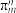 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则阳离子中的大
键中的电子数,则阳离子中的大 键可以表示为
键可以表示为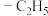 不能被H原子替换,请解释原因:
不能被H原子替换,请解释原因:
②
 也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出
也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出 的结构式
的结构式(4)为提高含氮碱性有机药物的水溶性,常用它们的盐酸盐。例如盐酸氨溴索(结构见如图)的阳离子可与水形成氢键,这些氢键表示式为O—H∙∙∙O(H2O)、

您最近一年使用:0次
解题方法
3 . 近日,科学家开发一种氮掺杂氢化镥(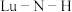 )材料和一种掺杂铜的铅磷灰石晶体结构,表现出超导特性。回答下列问题:
)材料和一种掺杂铜的铅磷灰石晶体结构,表现出超导特性。回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ ,它位于元素周期表___________ 区,最外层电子云轮廓图为___________ (填名称)。
(2)氮族元素的简单氢化物中最稳定的是___________ (填化学式,下同),沸点最低的是___________ 。
(3)近日,某新药上市,其活性成分的结构简式如图所示。
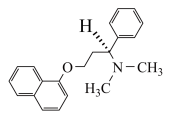
该分子中N原子的杂化轨道类型为___________ ,分子含___________ 个手性碳原子。
(4)含N的分子或离子是常见的配体。如雷氏盐的化学式为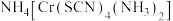 ,常作分析试剂。
,常作分析试剂。
① 的沸点比
的沸点比 高的主要原因是
高的主要原因是___________ , 分子易与
分子易与 形成配离子,而
形成配离子,而 不易形成配离子的原因是
不易形成配离子的原因是___________ 。
②雷氏盐中阳离子的空间结构为___________ (填字母,下同),阴离子的空间结构最可能的是___________ 。
A.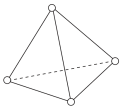 B.
B.
C.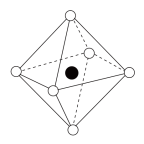 D.
D.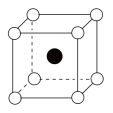
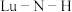 )材料和一种掺杂铜的铅磷灰石晶体结构,表现出超导特性。回答下列问题:
)材料和一种掺杂铜的铅磷灰石晶体结构,表现出超导特性。回答下列问题:(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为(2)氮族元素的简单氢化物中最稳定的是
(3)近日,某新药上市,其活性成分的结构简式如图所示。

该分子中N原子的杂化轨道类型为
(4)含N的分子或离子是常见的配体。如雷氏盐的化学式为
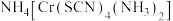 ,常作分析试剂。
,常作分析试剂。①
 的沸点比
的沸点比 高的主要原因是
高的主要原因是 分子易与
分子易与 形成配离子,而
形成配离子,而 不易形成配离子的原因是
不易形成配离子的原因是②雷氏盐中阳离子的空间结构为
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
解题方法
4 . 氧族元素包括氧、硫、硒等,这些元素的单质及其化合物在工农业生产和科学研究中具有广泛的用途。回答下列问题:
(1)下列属于氧原子激发态的轨道表示式的有___________ (填字母,下同),其中失去最外层上一个电子所需能量最低的是___________ 。
a. b.
b.
c.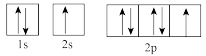 d.
d.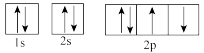
(2)科学研究表明,过硫化氢(也叫二硫化氢)加入烯烃中可制备硫醇,其熔沸点及制备方法如下表所示:
① 的结构为
的结构为 ,其中2个S原子的
,其中2个S原子的___________ 杂化轨道形成S—S___________ (填“ ”或“
”或“ ”)共价键。
”)共价键。
② 分子结构中H—O—O键角为
分子结构中H—O—O键角为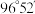 ,则
,则 分子结构中H—S—S键角
分子结构中H—S—S键角___________ (填“=”“>”或“<”)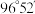 。
。
③ 的熔沸点比
的熔沸点比 的熔沸点低的原因是
的熔沸点低的原因是___________ 。
(3)在能源逐渐匮乏的形势下,超导材料显得尤为重要。Li、Fe、Se三种元素组成的某新型超导材料的晶胞结构如图所示:
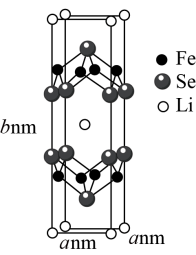
1个晶胞中的Se原子数为___________ 。晶胞的部分参数如图所示,且晶胞棱边夹角均为90°,晶体密度为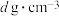 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ (列式表示)。
(1)下列属于氧原子激发态的轨道表示式的有
a.
 b.
b.
c.
 d.
d.
(2)科学研究表明,过硫化氢(也叫二硫化氢)加入烯烃中可制备硫醇,其熔沸点及制备方法如下表所示:
| 物质 | 熔点/℃ | 沸点/℃ |  制备方法 制备方法 |
 | -90.0 | 71.0 | 加热 至熔融,再把硫溶入其中,得多硫化钠溶液。在263K下,将该溶液注入稀硫酸中,得多硫化氢混合物,分离、干燥、真空蒸馏,即得 至熔融,再把硫溶入其中,得多硫化钠溶液。在263K下,将该溶液注入稀硫酸中,得多硫化氢混合物,分离、干燥、真空蒸馏,即得 |
 | -0.4 | 150.0 |
 的结构为
的结构为 ,其中2个S原子的
,其中2个S原子的 ”或“
”或“ ”)共价键。
”)共价键。②
 分子结构中H—O—O键角为
分子结构中H—O—O键角为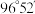 ,则
,则 分子结构中H—S—S键角
分子结构中H—S—S键角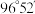 。
。③
 的熔沸点比
的熔沸点比 的熔沸点低的原因是
的熔沸点低的原因是(3)在能源逐渐匮乏的形势下,超导材料显得尤为重要。Li、Fe、Se三种元素组成的某新型超导材料的晶胞结构如图所示:

1个晶胞中的Se原子数为
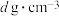 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
名校
5 . 火箭发射时可用 作燃料,
作燃料, 作氧化剂,其反应为
作氧化剂,其反应为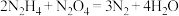 。
。 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 作燃料,
作燃料, 作氧化剂,其反应为
作氧化剂,其反应为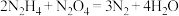 。
。 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.1.8 g  中氧的价层电子对数为 中氧的价层电子对数为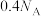 |
B.1 mol  中含有的π键数为 中含有的π键数为 |
C.当生成6.72 L 时转移电子数为 时转移电子数为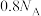 |
D.1 mol  中含有的质子数为 中含有的质子数为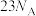 |
您最近一年使用:0次
6 . 我国科学家制取了具有特殊性能的化合物,该化合物的阴离子结构式如图所示,其中X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Y、Z位于同周期,且X是形成化合物种类最多的元素,Y、W属于同族元素。下列叙述错误的是
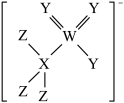
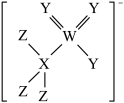
| A.X、Y、Z的简单氢化物分子间均可形成氢键 |
| B.非金属性:Z>Y>W |
| C.原子半径:W>Y>Z |
D.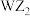 分子是极性分子 分子是极性分子 |
您最近一年使用:0次
2023-04-22更新
|
219次组卷
|
2卷引用:海南省海口市2023届高三下学期4月学生学科能力诊断化学试题
名校
解题方法
7 . 氯元素有多种化合价,可形成 、
、 、
、 、
、 、
、 、
、 等微粒。下列说法
等微粒。下列说法错误 的是
 、
、 、
、 、
、 、
、 、
、 等微粒。下列说法
等微粒。下列说法A. 、 、 、 、 中Cl原子的杂化方式相同 中Cl原子的杂化方式相同 |
| B.基态Cl原子核外电子的空间运动状态有9种 |
C.键角: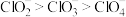 |
D. 的空间构型为V形 的空间构型为V形 |
您最近一年使用:0次
名校
解题方法
8 . 我国科学家最近揭示了叶片中C、N、P的化学含量以及环境调控。下列说法正确的是
A.基态原子的末成对电子数: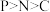 | B.电负性: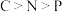 |
C.键角: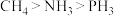 | D.第一电离能: |
您最近一年使用:0次
2022-05-31更新
|
256次组卷
|
2卷引用:海南省海口市2022届高三学生学科能力诊断(二)化学试题
解题方法
9 . PCl5、PCl3是有机合成的重要试剂,PCl5、PCl3的熔点依次为167℃、-93.6℃。PCl5的空间结构如图所示。下列说法正确的是
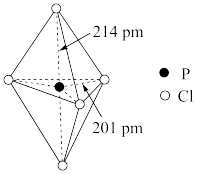
| A.1molPCl5分子含14mol共价键 | B.PCl3的空间结构为平面三角形 |
| C.键能不同导致PCl5、PCl3的熔点不同 | D.PCl5分子中共用电子对偏向氯 |
您最近一年使用:0次
2022-03-07更新
|
379次组卷
|
3卷引用:海南省2021-2022学年高三下学期化学学业水平诊断三(联考)化学试题
10 . 铜是人类最早发现并广泛使用的一种金属。黄铜矿是主要的炼铜原料, 是其中铜的主要存在形式。回答下列问题:
是其中铜的主要存在形式。回答下列问题:
(1)铜的价电子排布式为___________ ;
(2)稳定性:
___________  (填“<”“=”或“>”);并解释有关原因
(填“<”“=”或“>”);并解释有关原因___________ 。
(3) 中三种元素的电负性由大到小的顺序
中三种元素的电负性由大到小的顺序___________ (用元素符号表示)。
(4)在较低温度条件下, 与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为
与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为___________ ;X分子的立体构型为___________ 。
(5) 与浓硫酸反应可以得到硫酸铜,有关化学方程式为
与浓硫酸反应可以得到硫酸铜,有关化学方程式为___________ 。
(6)硫酸铜( )中阴离子的中心原子的杂化类型为
)中阴离子的中心原子的杂化类型为___________ 。
 是其中铜的主要存在形式。回答下列问题:
是其中铜的主要存在形式。回答下列问题:(1)铜的价电子排布式为
(2)稳定性:

 (填“<”“=”或“>”);并解释有关原因
(填“<”“=”或“>”);并解释有关原因(3)
 中三种元素的电负性由大到小的顺序
中三种元素的电负性由大到小的顺序(4)在较低温度条件下,
 与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为
与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为(5)
 与浓硫酸反应可以得到硫酸铜,有关化学方程式为
与浓硫酸反应可以得到硫酸铜,有关化学方程式为(6)硫酸铜(
 )中阴离子的中心原子的杂化类型为
)中阴离子的中心原子的杂化类型为
您最近一年使用:0次
2021-10-25更新
|
95次组卷
|
2卷引用:海南省华中师范大学琼中附属中学2022届高三第二次月考化学试题



