名校
解题方法
1 . 铁及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态Fe原子核外电子排布式为___________ 。
(2) 可与
可与 形成配离子
形成配离子 ,
, 可与NO形成配离子
可与NO形成配离子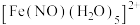 。
。
①S、N、O三种元素第一电离能由大到小的顺序为___________ 。
②每个 中含有σ键的数目是
中含有σ键的数目是___________ 。
(3) 的结构如图1所示。
的结构如图1所示。___________
②H2O中H-O-H键角___________ (填“>”“<”或“=”) 中O-S-O键角。
中O-S-O键角。
(4)由铁铜硫形成的某化合物的晶胞结构如图2所示。___________ 。
②若该晶体的密度为ρ g⋅cm ,则该晶胞的底面边长a=
,则该晶胞的底面边长a=___________ pm( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态Fe原子核外电子排布式为
(2)
 可与
可与 形成配离子
形成配离子 ,
, 可与NO形成配离子
可与NO形成配离子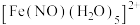 。
。①S、N、O三种元素第一电离能由大到小的顺序为
②每个
 中含有σ键的数目是
中含有σ键的数目是(3)
 的结构如图1所示。
的结构如图1所示。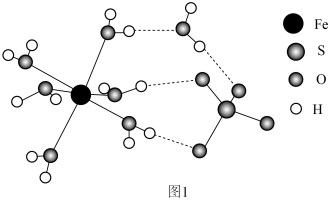
②H2O中H-O-H键角
 中O-S-O键角。
中O-S-O键角。(4)由铁铜硫形成的某化合物的晶胞结构如图2所示。
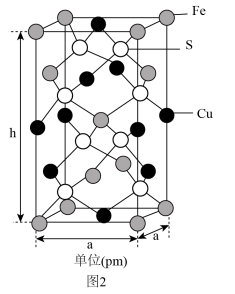
②若该晶体的密度为ρ g⋅cm
 ,则该晶胞的底面边长a=
,则该晶胞的底面边长a= 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
2 . 周期表中ⅢA族单质及其化合物应用广泛。BF3极易水解生成HBF4(HBF4在水溶液中完全电离为H+和 )和硼酸(H3BO3),硼酸是一元弱酸,能溶于水;硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯
)和硼酸(H3BO3),硼酸是一元弱酸,能溶于水;硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯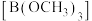 ;
; 是一种重要还原剂,其与热水反应生成
是一种重要还原剂,其与热水反应生成 和硼酸钠(
和硼酸钠( );高温下
);高温下 和焦炭在氯气的氛围中反应,生成
和焦炭在氯气的氛围中反应,生成 及一种剧毒气体;GaN是第三代半导体研究的热点。下列说法正确的是
及一种剧毒气体;GaN是第三代半导体研究的热点。下列说法正确的是
 )和硼酸(H3BO3),硼酸是一元弱酸,能溶于水;硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯
)和硼酸(H3BO3),硼酸是一元弱酸,能溶于水;硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯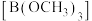 ;
; 是一种重要还原剂,其与热水反应生成
是一种重要还原剂,其与热水反应生成 和硼酸钠(
和硼酸钠( );高温下
);高温下 和焦炭在氯气的氛围中反应,生成
和焦炭在氯气的氛围中反应,生成 及一种剧毒气体;GaN是第三代半导体研究的热点。下列说法正确的是
及一种剧毒气体;GaN是第三代半导体研究的热点。下列说法正确的是A. 分子中不存在配位键 分子中不存在配位键 | B.每个H3BO3分子中含有5个共价键 |
C. 分子的空间结构为三角锥形 分子的空间结构为三角锥形 | D. 中B原子的杂化方式为 中B原子的杂化方式为 |
您最近一年使用:0次
名校
3 . 含元素R的微粒可发生如下反应: 下列说法错误的是
下列说法错误的是
 下列说法错误的是
下列说法错误的是| A.R元素的最高化合价为+7 | B.RO 的空间结构为三角锥形 的空间结构为三角锥形 |
| C.R2在常温常压下一定是气体 | D.R元素位于周期表中的s区 |
您最近一年使用:0次
名校
4 . 磷化氢(PH3)是一种无色剧毒,有类似大蒜气味的气体,微溶于冷水。下列关于PH3的叙述错误的是
| A.PH3分子中有未成键的电子对 |
| B.PH3是极性分子 |
| C.PH3分子结构为三角锥形 |
| D.PH3中共价键的键长比NH3的短 |
您最近一年使用:0次
5 . 化合物T是一种用于合成药物的重要试剂,其结构简式如图所示。已知X、Y、Z、M、N为原子序数依次增大的前四周期主族元素,Z、M位于同一主族,X、Y、N的最外层电子数之和等于Z的最外层电子数。下列有关叙述错误的是


A.简单离子半径: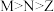 | B.简单氢化物稳定性: |
C.化合物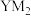 与 与 均为直线型分子 均为直线型分子 | D.化合物T中所有原子均符合8电子稳定结构 |
您最近一年使用:0次
名校
解题方法
6 . 氮(N)形成的单质及它形成的化合物有重要的研究和应用价值,回答下列问题:
(1)已知NO 与CO2互为等电子体,NO
与CO2互为等电子体,NO 的结构式为
的结构式为_______ ,中心原子N的杂化方式为_______ 。
(2)NH4BF4(四氟硼酸铵)可用作铝或铜的焊接助熔剂,能腐蚀玻璃,有重要的化工用途。下列说法正确的是________ 。
(3)向硫酸铜溶液中通入过量氨气,得到深蓝色溶液,生成配合物[Cu(NH3)4]SO4,其中1mol阳离子[Cu(NH3)4]2+中含有σ键数目为________ 。向该深蓝色溶液中加入乙醇,得到深蓝色晶体,该深蓝色晶体为________ (填化学式)。
(4)请从结构角度解释HNO3的酸性比HNO2强的原因________ 。
(1)已知NO
 与CO2互为等电子体,NO
与CO2互为等电子体,NO 的结构式为
的结构式为(2)NH4BF4(四氟硼酸铵)可用作铝或铜的焊接助熔剂,能腐蚀玻璃,有重要的化工用途。下列说法正确的是
| A.核素15N的中子数为7 | B.F元素位于元素周期表p区 |
C.BF 的空间构型为正四面体形 的空间构型为正四面体形 | D.NH4BF4中存在离子键、共价键、氢键和范德华力 |
(4)请从结构角度解释HNO3的酸性比HNO2强的原因
您最近一年使用:0次
名校
7 . 2022年春晚节目《只此青绿》取材于宋代名画《千里江山图》,该画描绘了山清水秀的美丽景色,历经千年色彩依然,其中青色来自蓝铜矿颜料[主要成分为Cu3(CO3)2(OH)2]。请回答下列问题:
(1)从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)___________ I2(Cu)(填“>”“<”或“=”)
(2) 的空间构型为
的空间构型为___________ 。
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是___________ (填元素符号),该配合物中采用sp2杂化的碳原子与sp3杂化的碳原子个数比为___________ 。

(1)从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)
(2)
 的空间构型为
的空间构型为(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是

您最近一年使用:0次
名校
8 . 下列有关化合物结构与性质的论述错误的是
| A.B3N3H6(无机苯)的结构与苯相似,其中形成大π键的电子全部由N提供 |
| B.根据原子半径推知,F-F键的键能大于Cl-Cl键,F2化学性质更稳定 |
| C.NH3的成键电子对间排斥力较大,所以NH3的键角比PH3大 |
| D.BF3和SO3中B、S杂化轨道类型相同,二者VSEPR模型均为平面三角形 |
您最近一年使用:0次
2023-04-02更新
|
491次组卷
|
4卷引用:山东省菏泽市曹县第一中学2022-2023学年高二下学期3月月考化学试题
名校
9 . 回答下列问题:
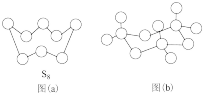
(1)图(a)为 的结构,其硫原子的杂化轨道类型为
的结构,其硫原子的杂化轨道类型为___________ 。
(2)气态三氧化硫以单分子形式存在,其分子的空间结构为___________ ;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。
(3) 分子中所有原子均满足8电子构型,
分子中所有原子均满足8电子构型, 分子中
分子中 键和
键和 键的个数比为
键的个数比为___________ ,中心原子的杂化方式为___________ 。
(4) 的分子结构如图所示,其中
的分子结构如图所示,其中 原子的杂化方式为
原子的杂化方式为___________ 。
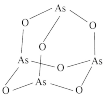
(5) 中,
中, 原子的轨道杂化方式为
原子的轨道杂化方式为___________ 。

(1)图(a)为
 的结构,其硫原子的杂化轨道类型为
的结构,其硫原子的杂化轨道类型为(2)气态三氧化硫以单分子形式存在,其分子的空间结构为
(3)
 分子中所有原子均满足8电子构型,
分子中所有原子均满足8电子构型, 分子中
分子中 键和
键和 键的个数比为
键的个数比为(4)
 的分子结构如图所示,其中
的分子结构如图所示,其中 原子的杂化方式为
原子的杂化方式为
(5)
 中,
中, 原子的轨道杂化方式为
原子的轨道杂化方式为
您最近一年使用:0次
2023-03-14更新
|
774次组卷
|
2卷引用:山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题
名校
解题方法
10 . 现有五种元素,其中Y、Z、W为同周期主族元素,Q为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)Q位于第______ 族______ 区。
(2)离子ZW 的空间结构为:
的空间结构为:___________ ;化合物X2W的价层电子对互斥模型为___________ 。
(3)比较ZX 和ZX3的键角∠XZX的大小:ZX
和ZX3的键角∠XZX的大小:ZX
_____ (填“>”“=”或“<”)ZX3。
(4)化合物X3Y–Y≡Z中,Y元素原子的杂化形式有___________ ,该化合物中σ键和π键的个数之比为___________ 。
| X元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| Y元素基态原子的最外层中p能级的电子数等于前一能层电子 |
| Z元素基态原子的未成对电子数目是同周期最多的 |
| W元素基态原子最外能层的p能级中有一个轨道填充2个电子 |
| Q在周期表的第七列 |
(2)离子ZW
 的空间结构为:
的空间结构为:(3)比较ZX
 和ZX3的键角∠XZX的大小:ZX
和ZX3的键角∠XZX的大小:ZX
(4)化合物X3Y–Y≡Z中,Y元素原子的杂化形式有
您最近一年使用:0次
2023-03-14更新
|
109次组卷
|
2卷引用:山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题



