名校
解题方法
1 . N、P同属于第VA族元素。试回答下列问题。
(1)基态N原子核外电子的空间运动状态有___________ 种。
(2)NH3分子可与Co3+形成配合物[Co(NH3)5Cl]Cl2,该配合物中H—N—H键角___________ (填“>”“<”或“=”)NH3分子中的H—N—H键角。1mol[Co(NH3)5Cl]Cl2中含有的σ键数目为___________ NA。
(3)磷和氢能组成一系列的氢化物,如PH3、P2H4、P12H16等。其中最重要的PH3。P2H4的沸点比PH3___________ (填“高”或“低”),原因是___________ 。
(4)乙二胺(H2NCH2CH2NH2)分子中氮原子的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其主要原因是___________ 。
(5)氮化硼、磷化铝、磷化镓(镓为第ⅢA族元素)晶胞结构都与金刚石的晶胞相似,熔点如下表所示,分析其变化的原因:___________ 。
(1)基态N原子核外电子的空间运动状态有
(2)NH3分子可与Co3+形成配合物[Co(NH3)5Cl]Cl2,该配合物中H—N—H键角
(3)磷和氢能组成一系列的氢化物,如PH3、P2H4、P12H16等。其中最重要的PH3。P2H4的沸点比PH3
(4)乙二胺(H2NCH2CH2NH2)分子中氮原子的杂化类型为
(5)氮化硼、磷化铝、磷化镓(镓为第ⅢA族元素)晶胞结构都与金刚石的晶胞相似,熔点如下表所示,分析其变化的原因:
| 物质 | 氮化硼 | 磷化铝 | 磷化镓 |
| 熔点 | 3000℃ | 2000℃ | 1477℃ |
您最近一年使用:0次
名校
解题方法
2 . 铜及其合金广泛应用于生活生产中。如黄铜合金可作首饰、镀层等。请回答下列问题:
(1)基态铜原子价电子排布式为___________ 。
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
① 中N原子的杂化类型是
中N原子的杂化类型是___________ ;NH3分子的立体构型是___________ 。
②[Cu(NH3)4]2+中提供孤对电子的基态原子有___________ 个未成对电子。1 mol该阳离子含有的σ键数目为___________
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是___________ ,NH3的沸点比NF3___________ ( 选填“高”或“低”),原因是___________ 。
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:
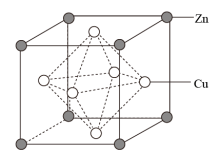
已知:晶胞参数为a nm。
①合金中粒子间作用力类型是___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
③黄铜合金晶体密度为___________ g·cm-3。(设NA为阿伏加德罗常数的值)
(1)基态铜原子价电子排布式为
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
①
 中N原子的杂化类型是
中N原子的杂化类型是②[Cu(NH3)4]2+中提供孤对电子的基态原子有
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

已知:晶胞参数为a nm。
①合金中粒子间作用力类型是
②与Cu原子等距离且最近的Cu原子有
③黄铜合金晶体密度为
您最近一年使用:0次
2021-12-31更新
|
591次组卷
|
3卷引用:云南省景东彝族自治县第一中学2022-2023学年高二下学期期末考试化学试题



