名校
解题方法
1 . N、P同属于第VA族元素。试回答下列问题。
(1)基态N原子核外电子的空间运动状态有___________ 种。
(2)NH3分子可与Co3+形成配合物[Co(NH3)5Cl]Cl2,该配合物中H—N—H键角___________ (填“>”“<”或“=”)NH3分子中的H—N—H键角。1mol[Co(NH3)5Cl]Cl2中含有的σ键数目为___________ NA。
(3)磷和氢能组成一系列的氢化物,如PH3、P2H4、P12H16等。其中最重要的PH3。P2H4的沸点比PH3___________ (填“高”或“低”),原因是___________ 。
(4)乙二胺(H2NCH2CH2NH2)分子中氮原子的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其主要原因是___________ 。
(5)氮化硼、磷化铝、磷化镓(镓为第ⅢA族元素)晶胞结构都与金刚石的晶胞相似,熔点如下表所示,分析其变化的原因:___________ 。
(1)基态N原子核外电子的空间运动状态有
(2)NH3分子可与Co3+形成配合物[Co(NH3)5Cl]Cl2,该配合物中H—N—H键角
(3)磷和氢能组成一系列的氢化物,如PH3、P2H4、P12H16等。其中最重要的PH3。P2H4的沸点比PH3
(4)乙二胺(H2NCH2CH2NH2)分子中氮原子的杂化类型为
(5)氮化硼、磷化铝、磷化镓(镓为第ⅢA族元素)晶胞结构都与金刚石的晶胞相似,熔点如下表所示,分析其变化的原因:
| 物质 | 氮化硼 | 磷化铝 | 磷化镓 |
| 熔点 | 3000℃ | 2000℃ | 1477℃ |
您最近一年使用:0次
名校
解题方法
2 . 氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。
已知:
Ⅰ.N2(g)+3H2(g) 2NH3(g) ΔH1=-92kJ•mol-1
2NH3(g) ΔH1=-92kJ•mol-1
Ⅱ.C(s)+O2(g) CO2(g) ΔH2=-394kJ•mo1-1
CO2(g) ΔH2=-394kJ•mo1-1
Ⅲ.N2(g)+3H2(g)+C(s)+O2(g) H2NCOONH4(s) ΔH3=-646kJ•mol-1
H2NCOONH4(s) ΔH3=-646kJ•mol-1
Ⅳ.H2NCOONH4(s) 2NH3(g)+CO2(g) ΔH4
2NH3(g)+CO2(g) ΔH4
回答下列问题:
(1)NH3的空间构型为________ ,NH3的键角大于PH3,分析原因为________ 。
(2)ΔH4=________ ;T℃下在某密闭容器中加入H2NCOONH4(s),假设只发生反应Ⅳ,达平衡时测得NH3的浓度为c1,保持温度不变,加压(缩小容器的体积),测得新的平衡条件下NH3的浓度为c2,则c1________ c2(填“>”“<”或“=”)。反应Ⅳ在________ (填“高温”“低温”或“任意温度”)条件下能够自发进行。
(3)某温度下在一刚性的密闭容器中,充入等物质的量N2和H2发生反应Ⅰ,起始压强为1MPa,10min末达平衡,测得平衡时压强为0.8MPa,则10min内v(N2)=________ MPa/min,此时平衡常数Kp=________ 。对于该条件下的反应,下列说法错误的是________ 。
A.当H2的体积分数不变时,说明反应已经达到化学平衡状态
B.温度升高化学反应速率加快,化学平衡常数增大
C.其他条件不变时,若适当增加N2的用量,可以提高H2的平衡转化率
D.使用合适的催化剂可以加快化学反应速率,但ΔH1不变
(4)在一定的条件下,将AmolN2和BmolH2充入某体积固定的密闭容器中合成NH3,在不同的催化剂(甲或乙)下发生反应,反应相同时间后H2的转化率与温度的关系如图:
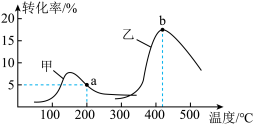
某学习小组的同学通过讨论得出结论:200℃时,a点对应的转化率(5%)不是使用催化剂甲、下H2的平衡转化率,判断依据是________ 。
已知:
Ⅰ.N2(g)+3H2(g)
 2NH3(g) ΔH1=-92kJ•mol-1
2NH3(g) ΔH1=-92kJ•mol-1Ⅱ.C(s)+O2(g)
 CO2(g) ΔH2=-394kJ•mo1-1
CO2(g) ΔH2=-394kJ•mo1-1Ⅲ.N2(g)+3H2(g)+C(s)+O2(g)
 H2NCOONH4(s) ΔH3=-646kJ•mol-1
H2NCOONH4(s) ΔH3=-646kJ•mol-1Ⅳ.H2NCOONH4(s)
 2NH3(g)+CO2(g) ΔH4
2NH3(g)+CO2(g) ΔH4回答下列问题:
(1)NH3的空间构型为
(2)ΔH4=
(3)某温度下在一刚性的密闭容器中,充入等物质的量N2和H2发生反应Ⅰ,起始压强为1MPa,10min末达平衡,测得平衡时压强为0.8MPa,则10min内v(N2)=
A.当H2的体积分数不变时,说明反应已经达到化学平衡状态
B.温度升高化学反应速率加快,化学平衡常数增大
C.其他条件不变时,若适当增加N2的用量,可以提高H2的平衡转化率
D.使用合适的催化剂可以加快化学反应速率,但ΔH1不变
(4)在一定的条件下,将AmolN2和BmolH2充入某体积固定的密闭容器中合成NH3,在不同的催化剂(甲或乙)下发生反应,反应相同时间后H2的转化率与温度的关系如图:

某学习小组的同学通过讨论得出结论:200℃时,a点对应的转化率(5%)不是使用催化剂甲、下H2的平衡转化率,判断依据是
您最近一年使用:0次
3 . 锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。
(1)基态Ge原子的电子排布式为_______ 。
(2) 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是_______ 分子(填“极性”或“非性极”)。
(3) 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为_______ (用元素符号表示), 中N的杂化方式为
中N的杂化方式为_______ 。
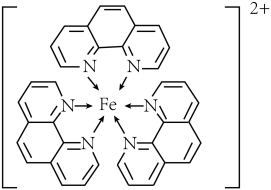
(4)如图所示的化合物,中心离子的配位数为_______ 。
(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:_______ 。
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为_______ ;已知晶胞边长为a pm,阿伏加德罗常数的值为 ,该晶胞密度
,该晶胞密度 为
为_______  (只列出计算式)。
(只列出计算式)。

(1)基态Ge原子的电子排布式为
(2)
 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是(3)
 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为 中N的杂化方式为
中N的杂化方式为(4)如图所示的化合物,中心离子的配位数为

(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为(
 ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为 ,该晶胞密度
,该晶胞密度 为
为 (只列出计算式)。
(只列出计算式)。
您最近一年使用:0次
名校
解题方法
4 . 铜及其合金广泛应用于生活生产中。如黄铜合金可作首饰、镀层等。请回答下列问题:
(1)基态铜原子价电子排布式为___________ 。
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
① 中N原子的杂化类型是
中N原子的杂化类型是___________ ;NH3分子的立体构型是___________ 。
②[Cu(NH3)4]2+中提供孤对电子的基态原子有___________ 个未成对电子。1 mol该阳离子含有的σ键数目为___________
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是___________ ,NH3的沸点比NF3___________ ( 选填“高”或“低”),原因是___________ 。
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:
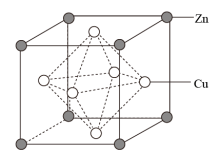
已知:晶胞参数为a nm。
①合金中粒子间作用力类型是___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
③黄铜合金晶体密度为___________ g·cm-3。(设NA为阿伏加德罗常数的值)
(1)基态铜原子价电子排布式为
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
①
 中N原子的杂化类型是
中N原子的杂化类型是②[Cu(NH3)4]2+中提供孤对电子的基态原子有
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

已知:晶胞参数为a nm。
①合金中粒子间作用力类型是
②与Cu原子等距离且最近的Cu原子有
③黄铜合金晶体密度为
您最近一年使用:0次
2021-12-31更新
|
581次组卷
|
3卷引用:云南省景东彝族自治县第一中学2022-2023学年高二下学期期末考试化学试题



