名校
1 . 地壳中含量排在前七位的元素分别是 ,占到地壳总质量的
,占到地壳总质量的 以上。回答下列问题:
以上。回答下列问题:
(1)“棕色环”现象是检验溶液中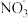 的一种方法。向含有
的一种方法。向含有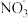 溶液的试管中加入
溶液的试管中加入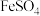 、随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
、随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。
① 中
中 元素采取
元素采取___________ 杂化,其立体构型为___________ (填名称)。
② 中含有的作用力类型有(填序号)
中含有的作用力类型有(填序号)___________ 。
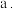 离子键
离子键 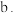 金属键
金属键  极性键
极性键  非极性键
非极性键  配位键
配位键
③ 中
中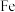 元素的化合价为
元素的化合价为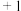 ,则铁的配体为
,则铁的配体为___________ (填化学式)。
(2)硅酸盐中的硅酸根通常以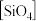 四面体(如图甲)的方式形成链状、环状或网络状复杂阴离子。图乙为一种环状硅酸根离子,写出其化学式:
四面体(如图甲)的方式形成链状、环状或网络状复杂阴离子。图乙为一种环状硅酸根离子,写出其化学式:___________ 。 属于
属于 型晶体,
型晶体, 占据由
占据由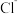 围成的八面体空隙。已知
围成的八面体空隙。已知 和
和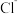 的半径分别为
的半径分别为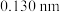 和
和 ,晶体中阴阳离子紧密相切。若
,晶体中阴阳离子紧密相切。若 晶体产生了阳离子空位(如图丙),请计算
晶体产生了阳离子空位(如图丙),请计算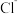 围成的最小窗孔的半径为
围成的最小窗孔的半径为___________ 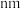 ,则
,则 晶体
晶体___________ (填“能”或“不能”)成为快离子导体。(已知: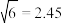 )
)
 ,占到地壳总质量的
,占到地壳总质量的 以上。回答下列问题:
以上。回答下列问题:(1)“棕色环”现象是检验溶液中
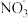 的一种方法。向含有
的一种方法。向含有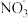 溶液的试管中加入
溶液的试管中加入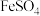 、随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
、随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。①
 中
中 元素采取
元素采取②
 中含有的作用力类型有(填序号)
中含有的作用力类型有(填序号) 离子键
离子键  金属键
金属键  极性键
极性键  非极性键
非极性键  配位键
配位键③
 中
中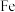 元素的化合价为
元素的化合价为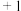 ,则铁的配体为
,则铁的配体为(2)硅酸盐中的硅酸根通常以
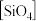 四面体(如图甲)的方式形成链状、环状或网络状复杂阴离子。图乙为一种环状硅酸根离子,写出其化学式:
四面体(如图甲)的方式形成链状、环状或网络状复杂阴离子。图乙为一种环状硅酸根离子,写出其化学式: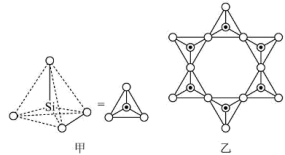
 属于
属于 型晶体,
型晶体, 占据由
占据由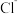 围成的八面体空隙。已知
围成的八面体空隙。已知 和
和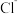 的半径分别为
的半径分别为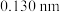 和
和 ,晶体中阴阳离子紧密相切。若
,晶体中阴阳离子紧密相切。若 晶体产生了阳离子空位(如图丙),请计算
晶体产生了阳离子空位(如图丙),请计算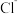 围成的最小窗孔的半径为
围成的最小窗孔的半径为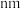 ,则
,则 晶体
晶体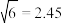 )
)
您最近半年使用:0次
名校
2 . 下列有关结构和性质的说法正确的是
| A.O3分子中存在非极性共价键,所以O3为非极性分子 |
| B.邻羟基苯甲醛能形成分子内氢键,而对羟基苯甲醛能形成分子间氢键,所以前者的熔点高于后者 |
| C.乙烯分子中两个碳原子间以sp2杂化轨道形成的σ键较稳定,未杂化的2p轨道形成的π键易断裂,所以易发生加成反应 |
| D.金属Li中的金属键比金属K中的金属键强,所以单质Li的还原性比K强 |
您最近半年使用:0次
名校
解题方法
3 . 氮、磷、砷 、锑
、锑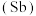 、铋
、铋 、镆
、镆 为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1) 中
中 键和
键和 键的数目比例是
键的数目比例是___________ ,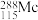 的中子数为
的中子数为___________ 。
(2)①已知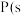 ,白磷)
,白磷) ,黑磷),该反应中
,黑磷),该反应中 的固态白磷转化为固态黑磷,放出
的固态白磷转化为固态黑磷,放出 的热量;
的热量;
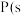 ,白磷)
,白磷) ,红磷),该反应中
,红磷),该反应中 的固态白磷转化为固态红磷,放出
的固态白磷转化为固态红磷,放出 的热量;
的热量;
由此推知,其中最稳定的磷单质是___________ 。
②比较氮和磷氢化物的热稳定性:
___________  (填“
(填“ ”“
”“ ”);写出
”);写出 结构式
结构式___________ 。
③ 与卤化氢的反应和
与卤化氢的反应和 与卤化氢的反应相似,产物的结构和性质也相似。
与卤化氢的反应相似,产物的结构和性质也相似。
下列对 与
与 反应产物的推断正确的是
反应产物的推断正确的是___________ (填序号)。
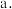 不能与
不能与 反应
反应  含离子键、共价键
含离子键、共价键  受热易分解
受热易分解
(3)已知 溶于水后的电离方程式为
溶于水后的电离方程式为 ,若分别向上述混合体系中加入稀硫酸、
,若分别向上述混合体系中加入稀硫酸、 溶液,则生成的正盐的化学式分别为
溶液,则生成的正盐的化学式分别为___________ 、___________ 。
(4) 能与水以等物质的量之比发生较强烈的反应,生成难溶的
能与水以等物质的量之比发生较强烈的反应,生成难溶的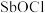 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(5)某工厂采用辉铋矿(主要成分为 ,含有
,含有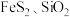 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制备
)联合焙烧法制备 和
和 ,工艺流程如图所示:
,工艺流程如图所示: 分解为
分解为 转变为
转变为 ;
;
②金属活动性: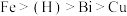 ;
;
③相关金属离子形成氢氧化物的 范围如下:
范围如下:
① 在元素周期表中的位置是
在元素周期表中的位置是___________ ,基态原子价层电子排布式为___________ 。
② 在空气中单独焙烧生成
在空气中单独焙烧生成 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
③滤渣的主要成分为___________ (填化学式)。
④生成气体 的离子方程式为
的离子方程式为___________ 。
⑤加入金属 的目的是
的目的是___________ 。
 、锑
、锑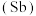 、铋
、铋 、镆
、镆 为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
为元素周期表中原子序数依次增大的同主族元素。回答下列问题:(1)
 中
中 键和
键和 键的数目比例是
键的数目比例是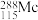 的中子数为
的中子数为(2)①已知
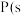 ,白磷)
,白磷) ,黑磷),该反应中
,黑磷),该反应中 的固态白磷转化为固态黑磷,放出
的固态白磷转化为固态黑磷,放出 的热量;
的热量;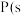 ,白磷)
,白磷) ,红磷),该反应中
,红磷),该反应中 的固态白磷转化为固态红磷,放出
的固态白磷转化为固态红磷,放出 的热量;
的热量;由此推知,其中最稳定的磷单质是
②比较氮和磷氢化物的热稳定性:

 (填“
(填“ ”“
”“ ”);写出
”);写出 结构式
结构式③
 与卤化氢的反应和
与卤化氢的反应和 与卤化氢的反应相似,产物的结构和性质也相似。
与卤化氢的反应相似,产物的结构和性质也相似。下列对
 与
与 反应产物的推断正确的是
反应产物的推断正确的是 不能与
不能与 反应
反应  含离子键、共价键
含离子键、共价键  受热易分解
受热易分解(3)已知
 溶于水后的电离方程式为
溶于水后的电离方程式为 ,若分别向上述混合体系中加入稀硫酸、
,若分别向上述混合体系中加入稀硫酸、 溶液,则生成的正盐的化学式分别为
溶液,则生成的正盐的化学式分别为(4)
 能与水以等物质的量之比发生较强烈的反应,生成难溶的
能与水以等物质的量之比发生较强烈的反应,生成难溶的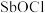 ,写出该反应的化学方程式
,写出该反应的化学方程式(5)某工厂采用辉铋矿(主要成分为
 ,含有
,含有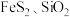 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制备
)联合焙烧法制备 和
和 ,工艺流程如图所示:
,工艺流程如图所示:
 分解为
分解为 转变为
转变为 ;
;②金属活动性:
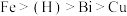 ;
;③相关金属离子形成氢氧化物的
 范围如下:
范围如下:开始沉淀 | 完全沉淀 | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
 在元素周期表中的位置是
在元素周期表中的位置是②
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,该反应的化学方程式为
,该反应的化学方程式为③滤渣的主要成分为
④生成气体
 的离子方程式为
的离子方程式为⑤加入金属
 的目的是
的目的是
您最近半年使用:0次
解题方法
4 . 石灰氮(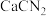 )是一种新型氮肥,与土壤中的
)是一种新型氮肥,与土壤中的 反应生成氰胺(
反应生成氰胺( ),氰胺可进一步转化为尿素[
),氰胺可进一步转化为尿素[ ]。下列说法正确的是
]。下列说法正确的是
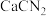 )是一种新型氮肥,与土壤中的
)是一种新型氮肥,与土壤中的 反应生成氰胺(
反应生成氰胺( ),氰胺可进一步转化为尿素[
),氰胺可进一步转化为尿素[ ]。下列说法正确的是
]。下列说法正确的是A. 和 和 空间构型相同,键角: 空间构型相同,键角: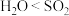 |
B. 为非极性分子 为非极性分子 |
C.中子数为20的钙原子可表示为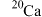 |
D. 分子中各元素的电负性大小关系为 分子中各元素的电负性大小关系为 |
您最近半年使用:0次
名校
解题方法
5 . 氟是卤族元素中原子半径最小的元素,氟的化合物种类繁多,用途广泛。回答下列问题:
(1)基态氟原子价电子的电子排布图为___________ ,其电子占据的最高能级的电子云轮廓图为___________ 。
(2) 和
和 均为离子晶体,其熔沸点如下表:
均为离子晶体,其熔沸点如下表:
 、
、 、
、 的离子半径从大到小顺序为
的离子半径从大到小顺序为___________ , 熔沸点比
熔沸点比 高的原因是
高的原因是___________ 。
(3)氟虫腈是一种广谱性杀虫剂,其结构简式如图甲:___________ 。晶体中不存在的化学键有___________ (填序号)
a.离子键 b. 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键
(4)全氟辛酸(如图乙)主要用作表面活性剂、乳化剂。全氟辛酸结构中,与每个碳原子(除羧基碳外)相连的F、C的空间构型为___________ (图中交叉点均为碳原子)。 具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为
具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为___________  。
。
(1)基态氟原子价电子的电子排布图为
(2)
 和
和 均为离子晶体,其熔沸点如下表:
均为离子晶体,其熔沸点如下表:| 熔点 | 沸点 | |
 | 993℃ | 1695℃ |
 | 1261℃ | 2260℃(分解) |
 、
、 、
、 的离子半径从大到小顺序为
的离子半径从大到小顺序为 熔沸点比
熔沸点比 高的原因是
高的原因是(3)氟虫腈是一种广谱性杀虫剂,其结构简式如图甲:

a.离子键 b.
 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键(4)全氟辛酸(如图乙)主要用作表面活性剂、乳化剂。全氟辛酸结构中,与每个碳原子(除羧基碳外)相连的F、C的空间构型为

 具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为
具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为 。
。
您最近半年使用:0次
名校
解题方法
6 . 元素化学是化学的基石,不同的元素往往呈现出五彩缤纷的特性。回答下列问题:
(1) 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为___________ ,还原性由强到弱的顺序为___________ 。
(2)H、B、N、F四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:___________ 。
(3)金元素形成的部分离子氧化性很强,化学家们推测可能和“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是__________。
(4)已知 ,
,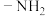 的N原子杂化方式为
的N原子杂化方式为___________ ;比较键角 :
: 中的
中的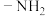
___________  中的
中的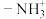 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),请说明理由
”),请说明理由___________ 。
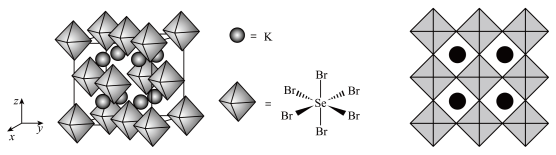
(5) 的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个
的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个 的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
的晶胞中Ⅰ型结构和Ⅱ型结构的比例是___________ ;___________ 。
②设X的最简式的式量为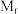 ,晶体密度为
,晶体密度为 ,则化合物X中相邻K之间的最短距离为
,则化合物X中相邻K之间的最短距离为___________ nm(列出计算式,阿伏加德罗常数的值为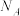 )。
)。
(1)
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为(2)H、B、N、F四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:
(3)金元素形成的部分离子氧化性很强,化学家们推测可能和“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是__________。
A.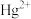 | B.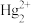 | C. | D. |
(4)已知
 ,
,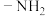 的N原子杂化方式为
的N原子杂化方式为 :
: 中的
中的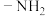
 中的
中的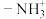 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),请说明理由
”),请说明理由(5)
 的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个
的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个 的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
②设X的最简式的式量为
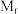 ,晶体密度为
,晶体密度为 ,则化合物X中相邻K之间的最短距离为
,则化合物X中相邻K之间的最短距离为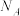 )。
)。
您最近半年使用:0次
名校
解题方法
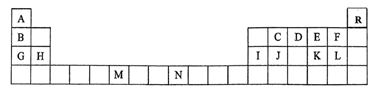
7 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)请根据对角线规则写出Be与NaOH 溶液反应的化学方程式___________ 。
(2)D的气态氢化物的VSEPR模型为___________ ,其中心原子的杂化类型为___________ 。
(3)G、H和Ⅰ的第一电离能数值由大到小的顺序为:___________ (用元素符号作答)。
(4)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是___________(填编号)。
(5)要证明太阳上是否含有R元素,可采用的方法是___________ 。
(6)与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有___________ (填元素符号)。
(7)C元素是形成有机物的主要元素,下列分子中含有sp和 杂化方式的是
杂化方式的是___________ (填字母)。
(1)请根据对角线规则写出Be与NaOH 溶液反应的化学方程式
(2)D的气态氢化物的VSEPR模型为
(3)G、H和Ⅰ的第一电离能数值由大到小的顺序为:
(4)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是___________(填编号)。
A. | B. | C. | D.苯 |
(6)与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有
(7)C元素是形成有机物的主要元素,下列分子中含有sp和
 杂化方式的是
杂化方式的是a.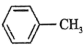 b.
b. c.
c. d.
d.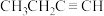
您最近半年使用:0次
名校
解题方法
8 . N、P同属于第VA族元素。试回答下列问题。
(1)基态N原子核外电子的空间运动状态有___________ 种。
(2)NH3分子可与Co3+形成配合物[Co(NH3)5Cl]Cl2,该配合物中H—N—H键角___________ (填“>”“<”或“=”)NH3分子中的H—N—H键角。1mol[Co(NH3)5Cl]Cl2中含有的σ键数目为___________ NA。
(3)磷和氢能组成一系列的氢化物,如PH3、P2H4、P12H16等。其中最重要的PH3。P2H4的沸点比PH3___________ (填“高”或“低”),原因是___________ 。
(4)乙二胺(H2NCH2CH2NH2)分子中氮原子的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其主要原因是___________ 。
(5)氮化硼、磷化铝、磷化镓(镓为第ⅢA族元素)晶胞结构都与金刚石的晶胞相似,熔点如下表所示,分析其变化的原因:___________ 。
(1)基态N原子核外电子的空间运动状态有
(2)NH3分子可与Co3+形成配合物[Co(NH3)5Cl]Cl2,该配合物中H—N—H键角
(3)磷和氢能组成一系列的氢化物,如PH3、P2H4、P12H16等。其中最重要的PH3。P2H4的沸点比PH3
(4)乙二胺(H2NCH2CH2NH2)分子中氮原子的杂化类型为
(5)氮化硼、磷化铝、磷化镓(镓为第ⅢA族元素)晶胞结构都与金刚石的晶胞相似,熔点如下表所示,分析其变化的原因:
| 物质 | 氮化硼 | 磷化铝 | 磷化镓 |
| 熔点 | 3000℃ | 2000℃ | 1477℃ |
您最近半年使用:0次
名校
解题方法
9 . 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的电子轨道排布式是___________ 。
(2)① 的键能为
的键能为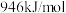 ,
, 单键的键能为
单键的键能为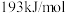 ,计算说明
,计算说明 中的
中的 键比
键比 键
键___________ (填“稳定”或“不稳定”)。氮容易形成三键,但与氮同主族的砷却难以形成三键的原因是___________ 。
②结合等电子体的知识判断离子 的空间构型为
的空间构型为___________ 。
(3)肼(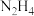 )分子可视为
)分子可视为 分子中的一个氢原子被-
分子中的一个氢原子被-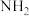 (氨基)取代形成的另一种氮的氢化物。
(氨基)取代形成的另一种氮的氢化物。
①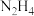 分子中氮原子轨道的杂化类型是
分子中氮原子轨道的杂化类型是___________ 。
②肼可用作火箭燃料,燃烧时发生的反应是:
 ;若该反应中有
;若该反应中有 键断裂,则形成的
键断裂,则形成的 键有
键有___________ mol。
③肼能与硫酸反应生成 。
。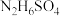 晶体类型与硫酸铵相同,则
晶体类型与硫酸铵相同,则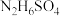 的晶体内存在的化学键
的晶体内存在的化学键___________ (填标号)。
a.离子键 b.共价键 c.金属键 d.配位键
(1)基态氮原子的电子轨道排布式是
(2)①
 的键能为
的键能为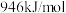 ,
, 单键的键能为
单键的键能为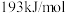 ,计算说明
,计算说明 中的
中的 键比
键比 键
键②结合等电子体的知识判断离子
 的空间构型为
的空间构型为(3)肼(
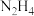 )分子可视为
)分子可视为 分子中的一个氢原子被-
分子中的一个氢原子被-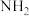 (氨基)取代形成的另一种氮的氢化物。
(氨基)取代形成的另一种氮的氢化物。①
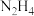 分子中氮原子轨道的杂化类型是
分子中氮原子轨道的杂化类型是②肼可用作火箭燃料,燃烧时发生的反应是:

 ;若该反应中有
;若该反应中有 键断裂,则形成的
键断裂,则形成的 键有
键有③肼能与硫酸反应生成
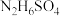 。
。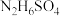 晶体类型与硫酸铵相同,则
晶体类型与硫酸铵相同,则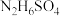 的晶体内存在的化学键
的晶体内存在的化学键a.离子键 b.共价键 c.金属键 d.配位键
您最近半年使用:0次
名校
解题方法
10 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)元素F简单离子的价电子排布式为___________ ;写出元素G在周期表中的位置___________ 。
(2)B与氢元素形成的简单气态氢化物的空间构型为___________ ,C与氢元素形成的简单气态氢化物的VSEPR模型为___________ 。
(3)C、D、E三种元素的简单离子半径由大到小的顺序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为___________ 。
(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ 化合物(填“离子”或“共价”);M的最高价氧化物对应的水化物与NaOH溶液反应的化学方程式为___________ 。
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: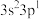 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)B与氢元素形成的简单气态氢化物的空间构型为
(3)C、D、E三种元素的简单离子半径由大到小的顺序为
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO
 ,该反应的离子方程式为
,该反应的离子方程式为
您最近半年使用:0次



