1 . 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸(
的沸点低于异硫氰酸(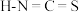 ),其原因是
),其原因是___________ 。
(2) 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为___________ ; 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为___________ 。
(3)卤素互化物如 等与卤素单质结构和性质相似。
等与卤素单质结构和性质相似。 沸点由高到低的顺序为
沸点由高到低的顺序为___________ 。
(4)请推测① 、②
、②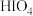 、③
、③ 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为___________ (填序号)。
(5) 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如图所示),
晶体的相似(如图所示), 晶体中的哑铃形
晶体中的哑铃形 的存在,使晶胞沿一个方向拉长。此晶体中1个
的存在,使晶胞沿一个方向拉长。此晶体中1个 周围距离最近的
周围距离最近的 为
为___________ 个;若该晶胞的边长为 ,则该晶体的密度为
,则该晶体的密度为___________  (写出表达式)。
(写出表达式)。

(1)拟卤素
 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸(
的沸点低于异硫氰酸(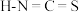 ),其原因是
),其原因是(2)
 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为(3)卤素互化物如
 等与卤素单质结构和性质相似。
等与卤素单质结构和性质相似。 沸点由高到低的顺序为
沸点由高到低的顺序为(4)请推测①
 、②
、②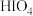 、③
、③ 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为(5)
 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如图所示),
晶体的相似(如图所示), 晶体中的哑铃形
晶体中的哑铃形 的存在,使晶胞沿一个方向拉长。此晶体中1个
的存在,使晶胞沿一个方向拉长。此晶体中1个 周围距离最近的
周围距离最近的 为
为 ,则该晶体的密度为
,则该晶体的密度为 (写出表达式)。
(写出表达式)。
您最近一年使用:0次
名校
解题方法
2 . 如图是元素周期表的一部分:
(1)写出①的元素符号___________ ,与①同周期的主族元素中,第一电离能比①大的有___________ 种。
(2)基态锑(Sb)原子的价电子排布式为___________ ;[H2F]+[SbF6]-(氟酸锑)是一种超强酸,[H2F]+离子的空间构型为___________ 。
(3)下列说法正确的是___________
a.元素Sb位于p区
b.基态P原子中,电子占据的最高能级符号为M
c.乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺低
d.升温实现液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键
(4)GaN、GaP都是很好的半导体材料,晶体类型与晶体硅类似,熔点如表所示,解释GaN、GaP熔点变化原因___________ 。
(5)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是___________ 。
(6)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如下图所示,已知该晶体密度为ρg•cm-3,NA是阿伏加德罗常数的值,BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为___________ pm(列式即可)。

| N | |||
| P | |||
| ① | |||
| Sb |
(2)基态锑(Sb)原子的价电子排布式为
(3)下列说法正确的是
a.元素Sb位于p区
b.基态P原子中,电子占据的最高能级符号为M
c.乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺低
d.升温实现液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键
(4)GaN、GaP都是很好的半导体材料,晶体类型与晶体硅类似,熔点如表所示,解释GaN、GaP熔点变化原因
| 物质 | GaN | GaP |
| 熔点/℃ | 1700 | 1480 |
(6)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如下图所示,已知该晶体密度为ρg•cm-3,NA是阿伏加德罗常数的值,BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为

您最近一年使用:0次
解题方法
3 . 硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
(1)在[Ni(NH3)6]2+中,Ni2+与NH3之间形成的化学键称为_______ ,提供孤电子对的成键原子是_______ (填元素符号)。
(2)[Ni(NH3)6]SO4中阴离子的空间结构是_______ 。
(3)在KCl、SiC、CO2、HF中,属于共价晶体的是_______ ,四种物质的熔点由高到低的顺序是_______ 。
(4)NaCl晶体的结构如下图所示:
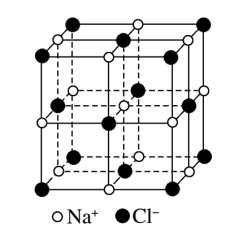
在NaCl晶体中,每个Na+周围同时吸引_______ 个Cl-,在NaCl晶胞中含有_______ 个Cl-,晶体中每个Na+周围与它距离最近且相等的Na+共有_______ 个。
(1)在[Ni(NH3)6]2+中,Ni2+与NH3之间形成的化学键称为
(2)[Ni(NH3)6]SO4中阴离子的空间结构是
(3)在KCl、SiC、CO2、HF中,属于共价晶体的是
(4)NaCl晶体的结构如下图所示:

在NaCl晶体中,每个Na+周围同时吸引
您最近一年使用:0次
解题方法
4 . 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
(1)在基态Ti原子中,核外存在_______ 对自旋相反的电子,核外电子占据最高能层的符号是_______ ,占据该能层电子的电子云轮廓图形状为_______ 。
(2) 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2
可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2
 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有_______ ;反应中涉及物质的元素中电负性最大的是_______ 。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是_______ 。
(3)高分子纳米活性钛无霸是借助紫外线或太阳光的照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解生活中的一些有害物质(如苯、甲醛、丙酮等)。
①丙酮( )分子中含有π键与σ键数目之比为
)分子中含有π键与σ键数目之比为_______ 。
②甲醛易溶于水,原因是:a.甲醛和水都是极性分子,b._______ 。
(4) 配离子呈黄色。配体之一
配离子呈黄色。配体之一 分子中氧原子的价层电子对互斥模型是
分子中氧原子的价层电子对互斥模型是_______ 。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体中Ti原子周围与Ti原子距离最近且相等的N原子的个数为_______ 。已知晶体的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为
,则晶胞边长为_______ cm(用含 、
、 的式子表示)。
的式子表示)。

(1)在基态Ti原子中,核外存在
(2)
 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2
可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2
 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有(3)高分子纳米活性钛无霸是借助紫外线或太阳光的照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解生活中的一些有害物质(如苯、甲醛、丙酮等)。
①丙酮(
 )分子中含有π键与σ键数目之比为
)分子中含有π键与σ键数目之比为②甲醛易溶于水,原因是:a.甲醛和水都是极性分子,b.
(4)
 配离子呈黄色。配体之一
配离子呈黄色。配体之一 分子中氧原子的价层电子对互斥模型是
分子中氧原子的价层电子对互斥模型是(5)有一种氮化钛晶体的晶胞如图所示,该晶体中Ti原子周围与Ti原子距离最近且相等的N原子的个数为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为
,则晶胞边长为 、
、 的式子表示)。
的式子表示)。
您最近一年使用:0次
22-23高三下·北京海淀·开学考试
名校
解题方法
5 . 砷化铝(AlAs)常用作光谱分析试剂和制备电子组件的原料,是一种新型半导体材料。回答下列问题:
(1)基态As原子的核外价电子排布图为_______ ;第一电离能I1(As)_______ I1(Se) (填“大于”或“小于”),其原因是_______ 。
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为_______ ;分子中As、S原子的杂化轨道类型分别为_______ 、_______ 。
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是_______ 、_______ 。
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为_______ ;该晶体密度为ρ g·cm-3,设NA为阿伏加德罗常数的值,晶胞参数为_______ pm。

(1)基态As原子的核外价电子排布图为
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为

您最近一年使用:0次
名校
解题方法
6 . LiFePO4、LiPF6、LiAsF6、LiCl等常用于锂离子聚合物电池。请回答:
(1)PO 的立体构型是
的立体构型是_____ ,Fe2+的价层电子轨道表示式是_____ 。
(2)题干中所给四种物质所含的非金属元素中,电负性最大的是_____ ,基态原子第一电离能最小的是_____ 。
(3)抗坏血酸( )常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是
)常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是_____ 。
(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①从化学键角度看,Li+迁移过程发生_____ (填“物理”或“化学”)变化。
②相同条件,Li+在_____ (选填“LiPF6”或“LiAsF6”)中迁移较快。
③图乙中X的杂化方式最可能是_____ (填字母编号)。
a.sp3 b.sp3d c.sp3d2 d.sp3d3
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属于正交晶系(长方体形),晶胞参数为0.75nm、1.0nm、0.56nm,如图1为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。

图1
①据此推断该晶胞中氯原子数目为_____ 。
②图中A、B两原子核间距离为_____ nm(只列计算式)。
(6)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10,失去1个电子需要的能量由大到小排序是_____ (填字母)。
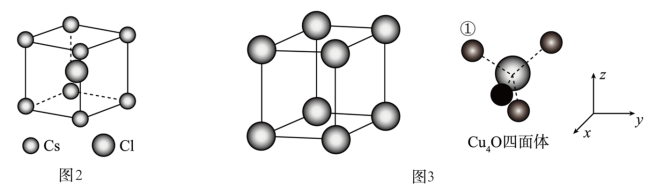
(7)Cu2O晶体结构与CsCl(图2)相似,只是利用Cu4O占据CsCl晶体中Cl的位置,而Cs位置由O原子占据,如图3所示,每个Cu2O晶胞中有_____ 个“Cu2O”;Cu2O晶胞中Cu的配位数是_____ ;若①处Cu原子坐标为( ,
, ,
, ),则Cu2O晶胞中Cu4O四面体中O原子坐标为
),则Cu2O晶胞中Cu4O四面体中O原子坐标为_____ 。
(1)PO
 的立体构型是
的立体构型是(2)题干中所给四种物质所含的非金属元素中,电负性最大的是
(3)抗坏血酸(
 )常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是
)常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①从化学键角度看,Li+迁移过程发生
②相同条件,Li+在
③图乙中X的杂化方式最可能是
a.sp3 b.sp3d c.sp3d2 d.sp3d3
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属于正交晶系(长方体形),晶胞参数为0.75nm、1.0nm、0.56nm,如图1为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。

图1
①据此推断该晶胞中氯原子数目为
②图中A、B两原子核间距离为
(6)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10,失去1个电子需要的能量由大到小排序是
| A.④②①③ | B.④②③① | C.①②④③ | D.①④③② |
 ,
, ,
, ),则Cu2O晶胞中Cu4O四面体中O原子坐标为
),则Cu2O晶胞中Cu4O四面体中O原子坐标为
您最近一年使用:0次
7 . 锂离子电池能够成为产业发展方向,主要基于其拥有较高的能量重量比和能量体积比等多项特性,正极材料为钴酸锂、锰酸锂和磷酸亚铁锂材料等。
(1)工业上用 、
、 、LiCl及苯胺(
、LiCl及苯胺( )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为_______ ,其在元素周期表中的位置为_______ ,O、N、P的电负性由大到小的顺序为_______ 。
(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。
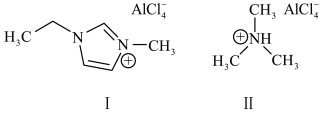
化合物Ⅰ中碳原子的杂化轨道类型为_______ ,1mol化合物Ⅰ中含有_______ 个σ键;化合物Ⅱ中阳离子的空间构型为_______ 。传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是_______ 。
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。
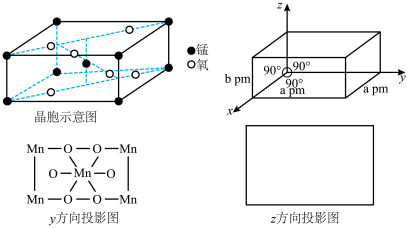
该锰的氧化物中Mn的化合价为_______ ,请画出z方向投影图_______ 。
(1)工业上用
 、
、 、LiCl及苯胺(
、LiCl及苯胺( )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。

化合物Ⅰ中碳原子的杂化轨道类型为
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。

该锰的氧化物中Mn的化合价为
您最近一年使用:0次
8 . 锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。
(1)基态Ge原子的电子排布式为_______ 。
(2) 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是_______ 分子(填“极性”或“非性极”)。
(3) 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为_______ (用元素符号表示), 中N的杂化方式为
中N的杂化方式为_______ 。
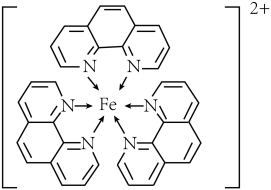
(4)如图所示的化合物,中心离子的配位数为_______ 。
(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:_______ 。
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为_______ ;已知晶胞边长为a pm,阿伏加德罗常数的值为 ,该晶胞密度
,该晶胞密度 为
为_______  (只列出计算式)。
(只列出计算式)。

(1)基态Ge原子的电子排布式为
(2)
 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是(3)
 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为 中N的杂化方式为
中N的杂化方式为(4)如图所示的化合物,中心离子的配位数为

(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为(
 ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为 ,该晶胞密度
,该晶胞密度 为
为 (只列出计算式)。
(只列出计算式)。
您最近一年使用:0次
名校
解题方法
9 . 现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)某同学根据上述信息,推断A基态原子的核外电子排布为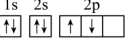 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了 _______ 。
(2)B元素的电负性_______ (填“大于”“小于”或“等于”)C元素的电负性。B元素的第一电离能 _______ (填“大于”“小于”或“等于”)C元素的第一电离能。
(3)AC 的空间结构为
的空间结构为 _______ ,中心原子的杂化轨道类型为 _______ 。
(4)E原子中电子占据的最高能层符号是_______ ,该能层具有的原子轨道数为 _______ 。
(5)F元素位于元素周期表中的_______ 区,F2+的价层电子轨道表达式为 _______ 。
(6)过量单质F与B的最高价氧化物对应的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为_______ 。
| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素基态原子p轨道有两个未成对电子 |
| D原子的第一至第四电离能分别是:I1=738kJ•mol﹣1;I2=1451kJ•mol﹣1;I2=7733kJ•mol﹣1;I4=10540kJ•mol﹣1 |
| E原子核外所有p轨道全满或半满 |
| F在周期表的第8纵列 |
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了 (2)B元素的电负性
(3)AC
 的空间结构为
的空间结构为 (4)E原子中电子占据的最高能层符号是
(5)F元素位于元素周期表中的
(6)过量单质F与B的最高价氧化物对应的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为
您最近一年使用:0次
解题方法
10 . 下列说法正确的是
A. 分子的极性比 分子的极性比 的大 的大 |
B.无机含氧酸的酸性: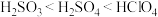 |
C. 的分子构型为 的分子构型为 形,则二甲醚的分子骨架 形,则二甲醚的分子骨架 构型为 构型为 形 形 |
D.键角: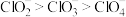 |
您最近一年使用:0次



