解题方法
1 . 硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
(1)在[Ni(NH3)6]2+中,Ni2+与NH3之间形成的化学键称为_______ ,提供孤电子对的成键原子是_______ (填元素符号)。
(2)[Ni(NH3)6]SO4中阴离子的空间结构是_______ 。
(3)在KCl、SiC、CO2、HF中,属于共价晶体的是_______ ,四种物质的熔点由高到低的顺序是_______ 。
(4)NaCl晶体的结构如下图所示:
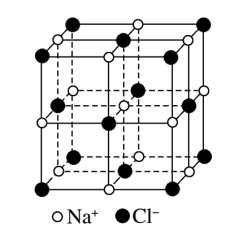
在NaCl晶体中,每个Na+周围同时吸引_______ 个Cl-,在NaCl晶胞中含有_______ 个Cl-,晶体中每个Na+周围与它距离最近且相等的Na+共有_______ 个。
(1)在[Ni(NH3)6]2+中,Ni2+与NH3之间形成的化学键称为
(2)[Ni(NH3)6]SO4中阴离子的空间结构是
(3)在KCl、SiC、CO2、HF中,属于共价晶体的是
(4)NaCl晶体的结构如下图所示:

在NaCl晶体中,每个Na+周围同时吸引
您最近一年使用:0次
名校
解题方法
2 . 现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)某同学根据上述信息,推断A基态原子的核外电子排布为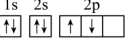 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了 _______ 。
(2)B元素的电负性_______ (填“大于”“小于”或“等于”)C元素的电负性。B元素的第一电离能 _______ (填“大于”“小于”或“等于”)C元素的第一电离能。
(3)AC 的空间结构为
的空间结构为 _______ ,中心原子的杂化轨道类型为 _______ 。
(4)E原子中电子占据的最高能层符号是_______ ,该能层具有的原子轨道数为 _______ 。
(5)F元素位于元素周期表中的_______ 区,F2+的价层电子轨道表达式为 _______ 。
(6)过量单质F与B的最高价氧化物对应的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为_______ 。
| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素基态原子p轨道有两个未成对电子 |
| D原子的第一至第四电离能分别是:I1=738kJ•mol﹣1;I2=1451kJ•mol﹣1;I2=7733kJ•mol﹣1;I4=10540kJ•mol﹣1 |
| E原子核外所有p轨道全满或半满 |
| F在周期表的第8纵列 |
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了 (2)B元素的电负性
(3)AC
 的空间结构为
的空间结构为 (4)E原子中电子占据的最高能层符号是
(5)F元素位于元素周期表中的
(6)过量单质F与B的最高价氧化物对应的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为
您最近一年使用:0次
解题方法
3 . 镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)科学家常利用___________ ,区分晶体硅和无定形硅。
(2)硒常用作光敏材料,根据元素周期律,原子半径Ga___________ As(填“>”或“<”,后同)。第一电离能Ga___________ As。与硒同周期的p区元素中第一电离能大于硒的元素有___________ 种; 的空间构型是
的空间构型是___________ 。
(3)GaN、GaP、GaAs都是很好的半导体材料,熔点如表所示,分析其变化原因:___________ 。
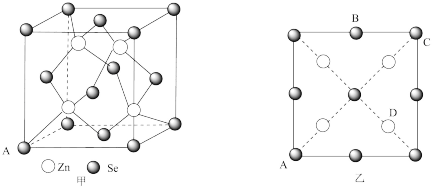
(4)硒化锌( )也是一种重要的半导体材料,其晶胞结构图甲所示,该晶胞中硒原子的配位数是
)也是一种重要的半导体材料,其晶胞结构图甲所示,该晶胞中硒原子的配位数是___________ ;已知晶胞边长为 ,乙图为甲图的俯视图,A点坐标为
,乙图为甲图的俯视图,A点坐标为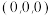 ,B点坐标为
,B点坐标为 ,则D点坐标
,则D点坐标___________ ;若该晶胞密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为___________  (只列出计算式)。
(只列出计算式)。
(1)科学家常利用
(2)硒常用作光敏材料,根据元素周期律,原子半径Ga
 的空间构型是
的空间构型是(3)GaN、GaP、GaAs都是很好的半导体材料,熔点如表所示,分析其变化原因:
| 物质 |  |  | 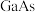 |
| 熔点 |  |  | 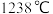 |
 )也是一种重要的半导体材料,其晶胞结构图甲所示,该晶胞中硒原子的配位数是
)也是一种重要的半导体材料,其晶胞结构图甲所示,该晶胞中硒原子的配位数是 ,乙图为甲图的俯视图,A点坐标为
,乙图为甲图的俯视图,A点坐标为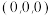 ,B点坐标为
,B点坐标为 ,则D点坐标
,则D点坐标 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为 (只列出计算式)。
(只列出计算式)。
您最近一年使用:0次
名校
解题方法
4 . 氧族元素是元素周期表中第VIA族元素,包含氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)五种元素,它们及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为____ 。
(2)H2O、H2S、H2Se、H2Te的沸点由高到低的顺序为____ ,原因是____ 。
(3)SO 与SO
与SO 相比,键角较小的是
相比,键角较小的是___ (填离子符号),原因是____ 。
(4)依布硒是一种有机硒化物,具有良好的抗炎活性,其结构简式为 。依布硒分子中
。依布硒分子中 、C原子的杂化类型分别为
、C原子的杂化类型分别为____ 、____ 。
(5)国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)“发电玻璃”被誉为“挂在墙上的油田”。碲化镉立方晶胞结构如图。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知晶胞中A、B原子的分数坐标分别为A(0,0,0)、B( ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为____ 。
②碲化镉晶体的密度为ρg•cm-3,设NA为阿伏加德罗常数的值,则其晶胞边长为a=____ 。
(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为(2)H2O、H2S、H2Se、H2Te的沸点由高到低的顺序为
(3)SO
 与SO
与SO 相比,键角较小的是
相比,键角较小的是(4)依布硒是一种有机硒化物,具有良好的抗炎活性,其结构简式为
 。依布硒分子中
。依布硒分子中 、C原子的杂化类型分别为
、C原子的杂化类型分别为(5)国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)“发电玻璃”被誉为“挂在墙上的油田”。碲化镉立方晶胞结构如图。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知晶胞中A、B原子的分数坐标分别为A(0,0,0)、B(
 ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为②碲化镉晶体的密度为ρg•cm-3,设NA为阿伏加德罗常数的值,则其晶胞边长为a=
您最近一年使用:0次
2022-05-26更新
|
368次组卷
|
4卷引用:河北省沧衡八校联盟2021-2022学年高二下学期期中考试化学试题
河北省沧衡八校联盟2021-2022学年高二下学期期中考试化学试题四川省雅安中学2022-2023学年高二上学期期中考试化学试题河北省沧州市任丘第一中学2021-2022学年高二下学期阶段考试(二)化学试题(已下线)期中模拟预测卷03(测试范围:选择性必修2+选择性必修3第1-2章)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)
名校
解题方法
5 . 钛被誉为“21世纪的金属”,可呈现多种化合价,其中以Ti4+最为稳定,回答下列问题:
(1)已知电离能:I2(Ti) =1310 kJ·mol-1,I2(K)=3051 kJ·mol-1,I2(Ti)<I2(K),其原因为_______ 。
(2)某种钛的化合物可用于催化环烯烃聚合,其结构如图所示:
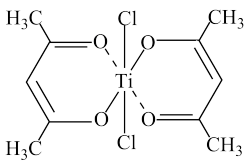
①碳原子的杂化轨道类型有_______ 。
②该化合物中存在的化学键有_______ (填字母)。
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
(3)钛与卤素形成化合物的熔、沸点如下表所示:
分析TiCl4、TiBr4、TiI4熔沸点呈现一定变化规律的原因是_______ 。
(4)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为_______ ,阴离子的空间结构为_______ 。

(1)已知电离能:I2(Ti) =1310 kJ·mol-1,I2(K)=3051 kJ·mol-1,I2(Ti)<I2(K),其原因为
(2)某种钛的化合物可用于催化环烯烃聚合,其结构如图所示:

①碳原子的杂化轨道类型有
②该化合物中存在的化学键有
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
(3)钛与卤素形成化合物的熔、沸点如下表所示:
| 化合物 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | -24.1 | 38.3 | 155 |
| 沸点/℃ | 136.5 | 233.5 | 377 |
(4)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为

您最近一年使用:0次
解题方法
6 . 随着环境污染及能源短缺的日益严重,汽车行业掀起了电动车热潮。2020年全球新能源汽车领导者比亚迪推出了“刀片电池”,大幅度提高了续航里程。刀片电池称为超级磷酸铁锂电池,其正极材料为 ,总反应式为:
,总反应式为: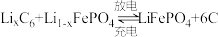 。回答下列问题:
。回答下列问题:
(1)Fe在元素周期表中的位置为___________ 。基态 比
比 结构稳定的原因可解释为
结构稳定的原因可解释为___________ 。
(2) 中Fe的化合价为
中Fe的化合价为___________ ,其离子常用___________ 试剂检验, 的空间构型为
的空间构型为___________ 。
(3)电池负极为嵌入Li的石墨烯层,其晶胞结构如下图。

①石墨烯是由碳原子形成的六元环状二维空间结构,其中C原子的杂化方式为___________ 。
②设 为阿伏加德罗常数的数值,该晶胞密度为
为阿伏加德罗常数的数值,该晶胞密度为___________  (列出计算式即可)。
(列出计算式即可)。
 ,总反应式为:
,总反应式为: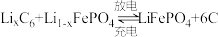 。回答下列问题:
。回答下列问题:(1)Fe在元素周期表中的位置为
 比
比 结构稳定的原因可解释为
结构稳定的原因可解释为(2)
 中Fe的化合价为
中Fe的化合价为 的空间构型为
的空间构型为(3)电池负极为嵌入Li的石墨烯层,其晶胞结构如下图。

①石墨烯是由碳原子形成的六元环状二维空间结构,其中C原子的杂化方式为
②设
 为阿伏加德罗常数的数值,该晶胞密度为
为阿伏加德罗常数的数值,该晶胞密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
7 . 2022年春晚节目《只此青绿》取材于宋代名画《千里江山图》,该画描绘了山清水秀的美丽景色,历经千年色彩依然,其中青色来自蓝铜矿颜料[主要成分为Cu3(CO3)2(OH)2]。请回答下列问题:
(1)基态铜原子价电子排布式为_______ 。从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)_______ I2(Cu) (填“>”“<”或“=”),并解释有关原因_______ 。
(2) 的空间构型为
的空间构型为_______ 。
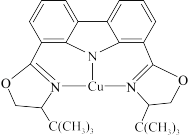
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是_______ (填元素符号),该配合物中采用sp2杂化的碳原子与sp3杂化的碳原子个数比为_______ 。
(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。
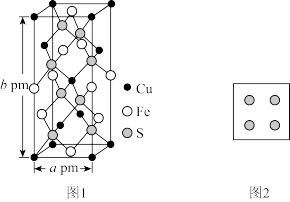
①Fe3+周围距离最近的S2-的个数为_______ 。
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为_______ mol-1(用a、b、ρ表示,并化成最简)。
(1)基态铜原子价电子排布式为
(2)
 的空间构型为
的空间构型为(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是

(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。

①Fe3+周围距离最近的S2-的个数为
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为
您最近一年使用:0次
2022-05-04更新
|
736次组卷
|
4卷引用:四川省南充高级中学2021-2022学年高二下学期期中考试化学试题
四川省南充高级中学2021-2022学年高二下学期期中考试化学试题安徽省淮北市2022届高三第二次模拟考试理科综合化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)山东省菏泽市单县第二中学2021-2022学年高二下学期慧光班段考化学试题
解题方法
8 . M、P、Q三种元素的相关信息如表:
(1)MO3是常见的M的氧化物,液态MO3有单分子MO3和三聚体(MO3)3两种形式;固态MO3主要以三聚体(MO3)3和无限长链(MO3)n两种形式存在。单分子MO3的空间构型为____ 。
②环状(MO3)3和链状(MO3)n的结构如图所示,环状(MO3)3中M原子的杂化轨道类型为____ ,链状(MO3)n中发生杂化的氧原子有____ 个(用含“n”的式于表示)。常温下,单分子MO3是液体,而链状(MO3)n是固体的原因是____ 。

(2)RH3BH3是目前最具潜力的储氢材料之一。
①RH3BH3能溶于水,其主要原因是____ 。
②RH3BH3分子中与R相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“R—H…H—B”表示.以下物质之间可能形成双氢键的是____ (填序号)。
A.LiH和HCN B.C6H6和CHCl3 C.C2H4和C2H2 D.B2H6和NH3
(3)含元素Q、钇(Y)、氧(O)的某正交相晶胞[YaQbOc]结构如图所示。

a:b:c=____ ,已知1号O原子空间坐标为(0,0, ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, +m,
+m, +n),则3号Fe原子的空间坐标为
+n),则3号Fe原子的空间坐标为____ 。若晶胞参数分别为apm、bpm和cpm,阿伏加德罗常数的值用NA表示,则该晶体的密度为____ g•cm-3(列表达式)。
| 元素 | 相关信息 |
| M | 基态原子的价电子排布式为3s23p4 |
| R | 空气中含量最多的元素 |
| Q | 常见金属元素,基态原子的M层有4个未成对的电子 |
②环状(MO3)3和链状(MO3)n的结构如图所示,环状(MO3)3中M原子的杂化轨道类型为

(2)RH3BH3是目前最具潜力的储氢材料之一。
①RH3BH3能溶于水,其主要原因是
②RH3BH3分子中与R相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“R—H…H—B”表示.以下物质之间可能形成双氢键的是
A.LiH和HCN B.C6H6和CHCl3 C.C2H4和C2H2 D.B2H6和NH3
(3)含元素Q、钇(Y)、氧(O)的某正交相晶胞[YaQbOc]结构如图所示。

a:b:c=
 ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, +m,
+m, +n),则3号Fe原子的空间坐标为
+n),则3号Fe原子的空间坐标为
您最近一年使用:0次
名校
解题方法
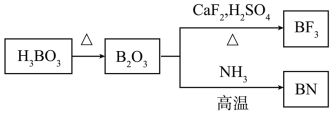
9 . Ⅰ.用硼镁矿(主要成分为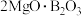 ,含
,含 、
、 、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图:
、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图:
(1)“酸浸”过程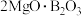 发生的主要化学反应方程式为
发生的主要化学反应方程式为_______ 。为避免“酸浸”产生大量气泡使物料溢出,应采取的措施为_______ 。
(2)“除杂”时向滤液中加入 和试剂a,
和试剂a, 的作用为
的作用为_______ (用离子方程式表示)。试剂a为_______ 。
(3)硫酸镁的溶解度随温度变化曲线如图所示。为从“母液”中充分回收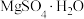 ,应保持“母液”在
,应保持“母液”在_______ ℃以上蒸发浓缩结晶、_______ ,再用乙醇洗涤后干燥。_______ 。
(5)在 中,F-B-F的键角是
中,F-B-F的键角是_______ , 和过NaF作用可生成
和过NaF作用可生成 ,
, 的空间结构为
的空间结构为_______ 。 的电子式为
的电子式为_______ 。
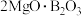 ,含
,含 、
、 、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图:
、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图: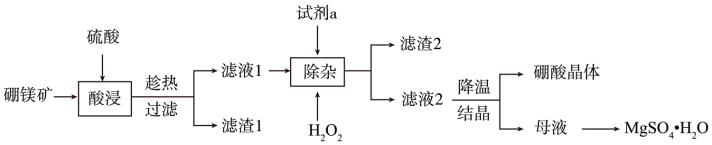
(1)“酸浸”过程
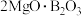 发生的主要化学反应方程式为
发生的主要化学反应方程式为(2)“除杂”时向滤液中加入
 和试剂a,
和试剂a, 的作用为
的作用为(3)硫酸镁的溶解度随温度变化曲线如图所示。为从“母液”中充分回收
 ,应保持“母液”在
,应保持“母液”在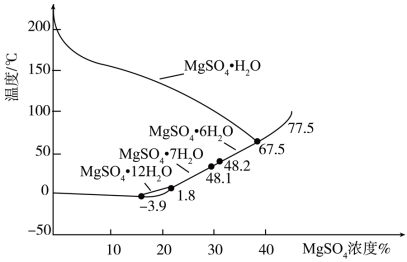
(5)在
 中,F-B-F的键角是
中,F-B-F的键角是 和过NaF作用可生成
和过NaF作用可生成 ,
, 的空间结构为
的空间结构为 的电子式为
的电子式为
您最近一年使用:0次
2022-05-03更新
|
286次组卷
|
2卷引用:广东省广州市第六中学2021-2022学年高二下学期期中测试化学试题
名校
解题方法
10 . 主族元素N、F、Si、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于_______ 晶体;SiCl4中Si采取的杂化类型为_______ 。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点低于Cl2O,原因是_______ 。
(3)Se元素基态原子的原子核外电子排布式为_______ ;As的第一电离能比Se的第一电离能大的原因为_______ 。
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ ;晶胞中A、B间距离d=_______ pm。
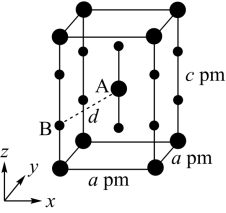
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于
(2)O、F、Cl电负性由大到小的顺序为
(3)Se元素基态原子的原子核外电子排布式为
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2022-05-02更新
|
860次组卷
|
7卷引用:山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题



