Ⅰ.用硼镁矿(主要成分为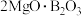 ,含
,含 、
、 、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图:
、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图:
(1)“酸浸”过程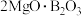 发生的主要化学反应方程式为
发生的主要化学反应方程式为_______ 。为避免“酸浸”产生大量气泡使物料溢出,应采取的措施为_______ 。
(2)“除杂”时向滤液中加入 和试剂a,
和试剂a, 的作用为
的作用为_______ (用离子方程式表示)。试剂a为_______ 。
(3)硫酸镁的溶解度随温度变化曲线如图所示。为从“母液”中充分回收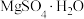 ,应保持“母液”在
,应保持“母液”在_______ ℃以上蒸发浓缩结晶、_______ ,再用乙醇洗涤后干燥。_______ 。
(5)在 中,F-B-F的键角是
中,F-B-F的键角是_______ , 和过NaF作用可生成
和过NaF作用可生成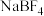 ,
,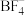 的空间结构为
的空间结构为_______ 。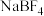 的电子式为
的电子式为_______ 。
 ,含
,含 、
、 、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图:
、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图: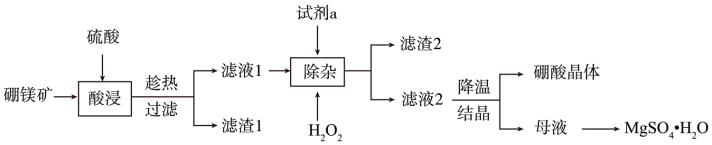
(1)“酸浸”过程
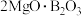 发生的主要化学反应方程式为
发生的主要化学反应方程式为(2)“除杂”时向滤液中加入
 和试剂a,
和试剂a, 的作用为
的作用为(3)硫酸镁的溶解度随温度变化曲线如图所示。为从“母液”中充分回收
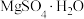 ,应保持“母液”在
,应保持“母液”在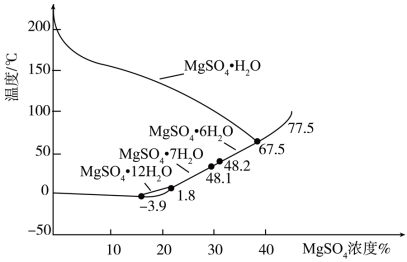
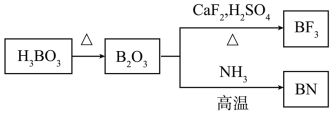
(5)在
 中,F-B-F的键角是
中,F-B-F的键角是 和过NaF作用可生成
和过NaF作用可生成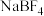 ,
,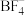 的空间结构为
的空间结构为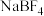 的电子式为
的电子式为
更新时间:2022-05-03 13:59:11
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】我国稀土工艺技术水平世界领先。从离子型稀土矿中(含RE、K、Al、Mg、Si、F等多种铝硅酸盐化合物,RE代表稀土元素)通过阳离子交换法提取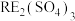 工艺流程如图。
工艺流程如图。
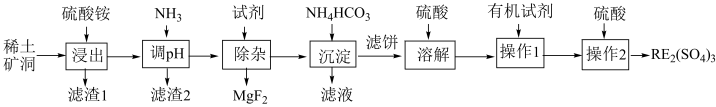
已知:①稀土矿中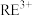 、
、 、
、 等主要吸附于铝硅酸盐中,稀土元素离子
等主要吸附于铝硅酸盐中,稀土元素离子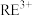
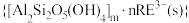 和杂质离子
和杂质离子 在矿洞中可与加入的盐溶液发生阳离子交换,将
在矿洞中可与加入的盐溶液发生阳离子交换,将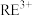 与
与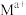 从铝硅酸盐中交换出来。
从铝硅酸盐中交换出来。
②常温下部分难溶物的溶度积如表:
③pH对稀土和铝浸出率的影响如图:

回答下列问题:
(1)“滤渣1”中存在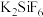 ,其阴离子的空间构型为
,其阴离子的空间构型为___________ 。“浸出”时最佳 为4.5,大于4.5稀土浸出率降低,解释原因
为4.5,大于4.5稀土浸出率降低,解释原因___________ 。
(2)矿洞中“浸出”时发生复杂反应,写出稀土离子交换的离子方程式___________ (注明物质状态)。
(3)“沉淀”稀土离子的离子方程式为___________ 。
(4)回收利用“滤液”的操作单元是___________ 。
(5)“操作2”的名称为___________ ,实验室进行该步操作需要用到的玻璃仪器有___________ 。
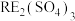 工艺流程如图。
工艺流程如图。
已知:①稀土矿中
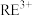 、
、 、
、 等主要吸附于铝硅酸盐中,稀土元素离子
等主要吸附于铝硅酸盐中,稀土元素离子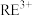
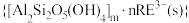 和杂质离子
和杂质离子 在矿洞中可与加入的盐溶液发生阳离子交换,将
在矿洞中可与加入的盐溶液发生阳离子交换,将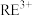 与
与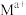 从铝硅酸盐中交换出来。
从铝硅酸盐中交换出来。②常温下部分难溶物的溶度积如表:
| 物质 | 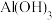 | 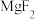 | 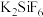 |
 | 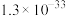 |  |  |

回答下列问题:
(1)“滤渣1”中存在
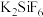 ,其阴离子的空间构型为
,其阴离子的空间构型为 为4.5,大于4.5稀土浸出率降低,解释原因
为4.5,大于4.5稀土浸出率降低,解释原因(2)矿洞中“浸出”时发生复杂反应,写出稀土离子交换的离子方程式
(3)“沉淀”稀土离子的离子方程式为
(4)回收利用“滤液”的操作单元是
(5)“操作2”的名称为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】含硅化合物在生活中的应用非常广泛。请回答下列问题:
(1)祖母绿宝石的主要成分化学式为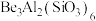 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
___________ 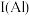 。
。
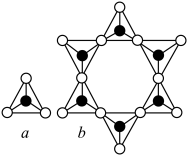
(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为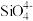 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是___________ (不能用最简式表示)。
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与 在300℃反应生成
在300℃反应生成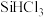 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为___________ ,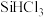 的空间构型为
的空间构型为___________ 。
(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是___________ 。
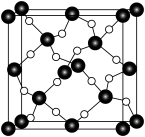
(5)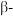 石英是晶质石英(
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为___________ ,请用价层电子对互斥模型解释图中键角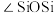 并不是
并不是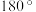 的原因是
的原因是___________ 。
(1)祖母绿宝石的主要成分化学式为
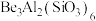 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
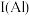 。
。(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为
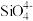 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与
 在300℃反应生成
在300℃反应生成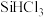 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为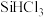 的空间构型为
的空间构型为(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是
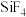 |  | 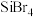 |  | |
| 沸点/K | 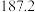 | 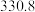 | 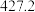 | 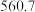 |
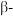 石英是晶质石英(
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为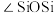 并不是
并不是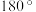 的原因是
的原因是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】《物质结构与性质》
(1)下列粒子的立体构型不是平面三角形的是___________ 。
A.CO32- B.NH3 C.BF3 D.SO3
(2)下列分子中,属于含极性键的非极性分子的是___________ 。
A.CH4 B.H2S C.C60 D.HCl
(3)现有四种离子晶体的晶胞,其离子排列方式如下列图所示,其中化学式不属于Mn型的是______ 。

(4)联合制碱法又称侯氏制碱法,其原理为:第一步NaCl+ NH3 + CO2+H2O=NaHCO3 + NH4Cl,第二步加热NaHCO3使其分解。关于第一步反应所包含的各物质中:
①属于离子化合物的是_________________ (填化学式);
②中心原子是sp杂化的分子是_________________ (填化学式);
③NaCl晶体中Na+的配位数为___________ ;
④写出H2O的任意一种等电子体的化学式___________ 。
(5)周期表前四周期的五种元素a、b、c、d、e,其核电荷数依次增大。a原子的核外电子总数与其周期数相同,b原子的最外层电子中有3个未成对电子,c原子的最外层电子数是其内层电子数的3倍,d与c同主族,e的价电子排布为3d104s1。
①b、c元素的第一电离能大小为:b_______ c(填“>"或“<”)
②d的基态原子的电子排布式为___________ ; a2d的VSKPK模型为___________ 。
③ba3和a2c两种分子键角较大的是___________ ;ba3极易溶于a2c的原因,除了两种分子都是极性
分子外,还因为____________________________ 。
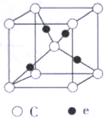
④e和c能形成一种化合物,其晶胞结构如右图所示,若设阿伏伽德罗常数值为NA,晶体的密度为d g/cm3,则晶胞参数a=_______ nm(用含d、NA的代数式表示)。
(1)下列粒子的立体构型不是平面三角形的是
A.CO32- B.NH3 C.BF3 D.SO3
(2)下列分子中,属于含极性键的非极性分子的是
A.CH4 B.H2S C.C60 D.HCl
(3)现有四种离子晶体的晶胞,其离子排列方式如下列图所示,其中化学式不属于Mn型的是

(4)联合制碱法又称侯氏制碱法,其原理为:第一步NaCl+ NH3 + CO2+H2O=NaHCO3 + NH4Cl,第二步加热NaHCO3使其分解。关于第一步反应所包含的各物质中:
①属于离子化合物的是
②中心原子是sp杂化的分子是
③NaCl晶体中Na+的配位数为
④写出H2O的任意一种等电子体的化学式
(5)周期表前四周期的五种元素a、b、c、d、e,其核电荷数依次增大。a原子的核外电子总数与其周期数相同,b原子的最外层电子中有3个未成对电子,c原子的最外层电子数是其内层电子数的3倍,d与c同主族,e的价电子排布为3d104s1。
①b、c元素的第一电离能大小为:b
②d的基态原子的电子排布式为
③ba3和a2c两种分子键角较大的是
分子外,还因为
④e和c能形成一种化合物,其晶胞结构如右图所示,若设阿伏伽德罗常数值为NA,晶体的密度为d g/cm3,则晶胞参数a=

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】科学家最近合成了VS2和VS相互交叉排列晶体.某小组以钒渣(含72%V2O3、14%Fe2O3、9%Al2O3、3%CuO,其余为有机杂质)为原料制备VS、VS2的流程如图:
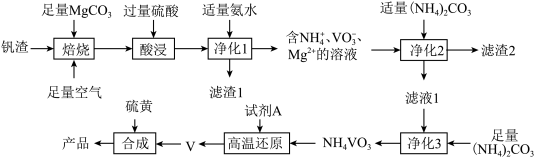
已知部分信息如下:
含钒离子在溶液中的主要存在形式与pH的关系如表所示。
②常温下,几种难溶电解质的溶度积如表:
③NH4VO3是白色粉末,微溶于冷水。
回答下列问题:
(1)基态V原子的核外电子排布式为______ ,NH 的空间结构为
的空间结构为______ 。
(2)“焙烧”时通入足量空气的目的是_____ 。
(3)“净化1”中,如果氨水过量,可能产生的影响是______ (填一种)。
(4)若“净化1”中调节pH=5,则c(Cu2+)=______ mol•L-1。
(5)“净化3”中洗涤NH4VO3时选择的洗涤剂为______ (填“冷水”或“热水”)。
(6)当试剂A为CO时,写出“高温还原”时发生反应的化学方程式:______ 。
(7)某工厂用1吨该钒渣制备VS、VS2,若该工艺流程中,V的损耗率为5%,则最终得到产品的质量为______ kg。[已知产品中n(VS):n(VS2)=1:1]。

已知部分信息如下:
含钒离子在溶液中的主要存在形式与pH的关系如表所示。
| pH | 4~6 | 6~8 | 8~10 |
| 主要离子 | VO | VO | V2O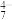 |
②常温下,几种难溶电解质的溶度积如表:
| 难溶电解质 | Cu(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| Ksp | 2.2×10-22 | 4.0×10-38 | 1.3×10-33 | 1.8×10-11 |
③NH4VO3是白色粉末,微溶于冷水。
回答下列问题:
(1)基态V原子的核外电子排布式为
 的空间结构为
的空间结构为(2)“焙烧”时通入足量空气的目的是
(3)“净化1”中,如果氨水过量,可能产生的影响是
(4)若“净化1”中调节pH=5,则c(Cu2+)=
(5)“净化3”中洗涤NH4VO3时选择的洗涤剂为
(6)当试剂A为CO时,写出“高温还原”时发生反应的化学方程式:
(7)某工厂用1吨该钒渣制备VS、VS2,若该工艺流程中,V的损耗率为5%,则最终得到产品的质量为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】非金属在生产、生活和科研中应用广泛。回答下列问题:
(1)基态 F 原子的电子排布式为_______ 。
(2)N2F2(二氟氮烯)分子中,氮原子的杂化类型为 sp2,则 N2F2 的结构式为_______ 。
(3)OF2 主要用于火箭工程液体助燃剂,其分子的空间构型为_______ ;OF2 的熔、沸点_______ Cl2O (填“高于”或“低于”),原因是_______ 。
(4)NO 、NO
、NO 、NO
、NO 的键角由大到小的顺序是
的键角由大到小的顺序是_______ 。
(5)碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因_______ 。
(6)FeS2 晶体的晶胞结构如图所示。在晶胞中,Fe2+位于S 所形成的
所形成的_______ (填“正四面体”或 “正八面体”)空隙;若晶胞参数为 a nm,密度为ρg·cm −3 ,阿伏加德罗常数的值为NA ,则FeS2 的摩尔质量 M=_______  (用含 a、ρ、NA 的代数式表示)。
(用含 a、ρ、NA 的代数式表示)。

(1)基态 F 原子的电子排布式为
(2)N2F2(二氟氮烯)分子中,氮原子的杂化类型为 sp2,则 N2F2 的结构式为
(3)OF2 主要用于火箭工程液体助燃剂,其分子的空间构型为
(4)NO
 、NO
、NO 、NO
、NO 的键角由大到小的顺序是
的键角由大到小的顺序是(5)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(6)FeS2 晶体的晶胞结构如图所示。在晶胞中,Fe2+位于S
 所形成的
所形成的 (用含 a、ρ、NA 的代数式表示)。
(用含 a、ρ、NA 的代数式表示)。 
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】磷酸盐几乎是所有食物的天然成分之一,作为重要的食品配料和功能添加剂被广泛用于食品加工中。在食品加工中使用的磷酸盐通常为钠盐钙盐、钾盐以及作为营养强化剂的铁盐和锌盐。天然存在的磷酸盐是磷矿石[主要成分为 ,同时还有
,同时还有 等],用硫酸跟磷矿石反应,能生成被植物吸收的
等],用硫酸跟磷矿石反应,能生成被植物吸收的 。
。
回答下列问题:
(1)金属铁可导电、导热,具有金属光泽,有延展性,这些性质都可以用“_______ 理论”解释。
(2) 硬而脆,其原因是
硬而脆,其原因是_______ 。
(3)Ca、Fe、K、Zn的第一电离能由大到小的顺序为_______ 。
(4)O、Si、P、S四种元素形成的最简单氢化物的稳定性最强的是_______ (填化学式); 难溶于水却易溶于
难溶于水却易溶于 ,其原因为
,其原因为_______ 。
(5) 的空间构型为
的空间构型为_______ ,酸性条件下, 可与
可与 形成
形成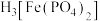 从而掩蔽溶液中的
从而掩蔽溶液中的 ,基态
,基态 核外M层有
核外M层有_______ 种空间运动状态不同的电子。
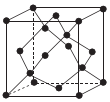
(6)单晶硅的晶体结构与金刚石的一种晶体结构相似,其结构如图所示,则晶胞中Si原子的体积占晶胞体积的百分率为_______ (列出计算式即可)。已知该晶体的密度为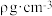 ,NA是阿伏加德罗常数的值。晶胞中面心上6个Si原子相连构成正八面体,该正八面体的边长为
,NA是阿伏加德罗常数的值。晶胞中面心上6个Si原子相连构成正八面体,该正八面体的边长为_______ pm。
 ,同时还有
,同时还有 等],用硫酸跟磷矿石反应,能生成被植物吸收的
等],用硫酸跟磷矿石反应,能生成被植物吸收的 。
。回答下列问题:
(1)金属铁可导电、导热,具有金属光泽,有延展性,这些性质都可以用“
(2)
 硬而脆,其原因是
硬而脆,其原因是(3)Ca、Fe、K、Zn的第一电离能由大到小的顺序为
(4)O、Si、P、S四种元素形成的最简单氢化物的稳定性最强的是
 难溶于水却易溶于
难溶于水却易溶于 ,其原因为
,其原因为(5)
 的空间构型为
的空间构型为 可与
可与 形成
形成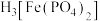 从而掩蔽溶液中的
从而掩蔽溶液中的 ,基态
,基态 核外M层有
核外M层有(6)单晶硅的晶体结构与金刚石的一种晶体结构相似,其结构如图所示,则晶胞中Si原子的体积占晶胞体积的百分率为
 ,NA是阿伏加德罗常数的值。晶胞中面心上6个Si原子相连构成正八面体,该正八面体的边长为
,NA是阿伏加德罗常数的值。晶胞中面心上6个Si原子相连构成正八面体,该正八面体的边长为
您最近一年使用:0次
【推荐1】硫氰化钾(KSCN)俗称玫瑰红酸钾,主要用于合成树脂、杀虫杀菌剂等。某小组通过实验制备硫氰化钾,探究其性质,测定其含量。已知:
①NH3不溶于CS2,CS2密度比水大且不溶于水;
②3NH3+CS2 NH4SCN+NH4HS,该反应比较缓慢。NH4SCN、NH4HS和(NH4)2CO3的分解温度依次是170℃、105℃、58℃;
NH4SCN+NH4HS,该反应比较缓慢。NH4SCN、NH4HS和(NH4)2CO3的分解温度依次是170℃、105℃、58℃;
③SCN-+Ag+=AgSCN↓(白色)。
回答下列问题:
I.制备:
(1)在反应釜中加入固体催化剂与CS2,加压条件下通入氨气,水浴加热充分反应。加压的目的是____ 、____ 。
(2)反应后将反应釜保持105℃一段时间,其目的是____ 。
(3)适宜温度下向反应釜中滴入适量的K2CO3溶液,过滤。反应的化学方程式是____ 。滤液继续进行的操作是减压____ 、____ 过滤、洗涤、干燥,得到硫氰化钾晶体。
II.性质探究:
(4)向氯化亚铁溶液中滴加KSCN溶液,再滴加少量氯水,观察到的现象是____ ,继续滴加氯水颜色先变深后消失,可推断出离子还原性的结论是____ 。
III.含量测定:
(5)测定晶体中KSCN的含量(KSCN的摩尔质量为Mg/mol):取ag待测试样溶于蒸馏水配成250mL溶液;取25.00mL待测液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3作指示剂;用0.1000mol/LAgNO3标准溶液滴定至终点,平行滴定三次,平均消耗AgNO3标准溶液12mL。
晶体中KSCN的含量为____ %(用含a、M的代数式表示);若其它操作及读数均正确,下列操作会导致所测定KSCN的含量偏高的是____ (填字母)。
A.滴加AgNO3标准溶液时,滴加前仰视读数,滴加后俯视读数
B.滴加AgNO3标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
C.配制AgNO3标准溶液时,烧杯中的溶液有少量溅出
D.滴定过程中,将挂在锥形瓶壁上的AgNO3标准溶液用蒸馏水冲进瓶内
①NH3不溶于CS2,CS2密度比水大且不溶于水;
②3NH3+CS2
 NH4SCN+NH4HS,该反应比较缓慢。NH4SCN、NH4HS和(NH4)2CO3的分解温度依次是170℃、105℃、58℃;
NH4SCN+NH4HS,该反应比较缓慢。NH4SCN、NH4HS和(NH4)2CO3的分解温度依次是170℃、105℃、58℃;③SCN-+Ag+=AgSCN↓(白色)。
回答下列问题:
I.制备:
(1)在反应釜中加入固体催化剂与CS2,加压条件下通入氨气,水浴加热充分反应。加压的目的是
(2)反应后将反应釜保持105℃一段时间,其目的是
(3)适宜温度下向反应釜中滴入适量的K2CO3溶液,过滤。反应的化学方程式是
II.性质探究:
(4)向氯化亚铁溶液中滴加KSCN溶液,再滴加少量氯水,观察到的现象是
III.含量测定:
(5)测定晶体中KSCN的含量(KSCN的摩尔质量为Mg/mol):取ag待测试样溶于蒸馏水配成250mL溶液;取25.00mL待测液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3作指示剂;用0.1000mol/LAgNO3标准溶液滴定至终点,平行滴定三次,平均消耗AgNO3标准溶液12mL。
晶体中KSCN的含量为
A.滴加AgNO3标准溶液时,滴加前仰视读数,滴加后俯视读数
B.滴加AgNO3标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
C.配制AgNO3标准溶液时,烧杯中的溶液有少量溅出
D.滴定过程中,将挂在锥形瓶壁上的AgNO3标准溶液用蒸馏水冲进瓶内
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】碳酸锂是制备其他锂化合物的关键原料。一种以磷酸锂渣(主要成分 )为原料制备碳酸锂的工艺流程示意图如下。
)为原料制备碳酸锂的工艺流程示意图如下。
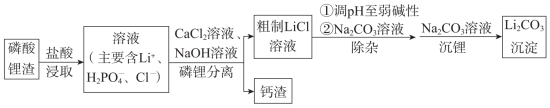
已知:部分物质的溶解性表(20℃)
(1)写出浸取时 与盐酸反应的化学方程式:
与盐酸反应的化学方程式:_______ 。
(2)加入盐酸的量不宜过多的原因是_______ 。
(3)钙渣的主要成分是_______ 。
(4)磷锂分离时,需要不断加入适量 溶液以维持溶液的
溶液以维持溶液的 基本不变。结合离子方程式解释其原因是
基本不变。结合离子方程式解释其原因是_______ 。
(5)沉锂时,反应的离子方程式是_______ 。
(6)若粗制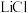 溶液中
溶液中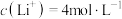 ,
,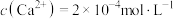 。则沉锂前溶液中能达到的
。则沉锂前溶液中能达到的 的最小浓度是
的最小浓度是_______  。(已知:25℃时,
。(已知:25℃时, 的
的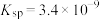 ,
, 的
的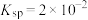 )
)
 )为原料制备碳酸锂的工艺流程示意图如下。
)为原料制备碳酸锂的工艺流程示意图如下。
已知:部分物质的溶解性表(20℃)
| 阳离子 | 阴离子 | ||
 | 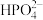 | 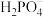 | |
 | 难溶 | 可溶 | 易溶 |
 | 难溶 | 难溶 | 可溶 |
(1)写出浸取时
 与盐酸反应的化学方程式:
与盐酸反应的化学方程式:(2)加入盐酸的量不宜过多的原因是
(3)钙渣的主要成分是
(4)磷锂分离时,需要不断加入适量
 溶液以维持溶液的
溶液以维持溶液的 基本不变。结合离子方程式解释其原因是
基本不变。结合离子方程式解释其原因是(5)沉锂时,反应的离子方程式是
(6)若粗制
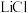 溶液中
溶液中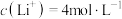 ,
,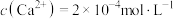 。则沉锂前溶液中能达到的
。则沉锂前溶液中能达到的 的最小浓度是
的最小浓度是 。(已知:25℃时,
。(已知:25℃时, 的
的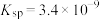 ,
, 的
的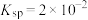 )
)
您最近一年使用:0次
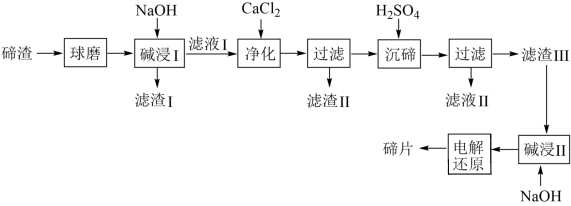
【推荐3】某工业废渣主要成分为TeO2,含有CuO、SiO2和Ag2O杂质,从碲渣中回收碲的工艺流程如下:
某化学课外小组通过查阅资料,获取以下信息:
I.Te常见化合价为+4价;
Ⅱ.二氧化碲(TeO2)是白色晶体,微溶于水,易溶于强酸或强碱生成盐;
Ⅲ.Na2TeO3在微酸性和中性水溶液中易水解生成相应的氧化物。
回答下列问题:
(1)“球磨”的目的是_____ 。
(2)“碱浸I”二氧化碲(TeO2)被碱溶解发生的化学方程式为_____ ,“滤渣I”的成分为_____ 。
(3)“净化”中加入CaCl2,除去Si元素的离子方程式_____ 。
(4)若“沉碲”时所得溶液的pH为7,此时溶液中c(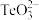 )/c(H2TeO3)=
)/c(H2TeO3)=_____ (已知:H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8);“沉碲”时溶液的pH应控制在5.8~7.6,原因是_____ 。
(5)“滤渣Ⅲ”的主要成分是_____ 。
(6)“电解还原”过程中,Te被还原的电极反应式为_____ 。

某化学课外小组通过查阅资料,获取以下信息:
I.Te常见化合价为+4价;
Ⅱ.二氧化碲(TeO2)是白色晶体,微溶于水,易溶于强酸或强碱生成盐;
Ⅲ.Na2TeO3在微酸性和中性水溶液中易水解生成相应的氧化物。
回答下列问题:
(1)“球磨”的目的是
(2)“碱浸I”二氧化碲(TeO2)被碱溶解发生的化学方程式为
(3)“净化”中加入CaCl2,除去Si元素的离子方程式
(4)若“沉碲”时所得溶液的pH为7,此时溶液中c(
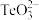 )/c(H2TeO3)=
)/c(H2TeO3)=(5)“滤渣Ⅲ”的主要成分是
(6)“电解还原”过程中,Te被还原的电极反应式为
您最近一年使用:0次



