含硅化合物在生活中的应用非常广泛。请回答下列问题:
(1)祖母绿宝石的主要成分化学式为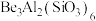 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
___________ 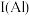 。
。
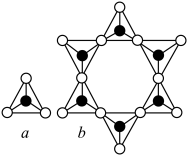
(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是___________ (不能用最简式表示)。
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与 在300℃反应生成
在300℃反应生成 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为___________ , 的空间构型为
的空间构型为___________ 。
(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是___________ 。
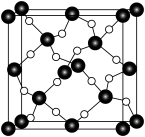
(5) 石英是晶质石英(
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为___________ ,请用价层电子对互斥模型解释图中键角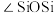 并不是
并不是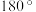 的原因是
的原因是___________ 。
(1)祖母绿宝石的主要成分化学式为
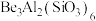 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
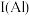 。
。(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为
 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与
 在300℃反应生成
在300℃反应生成 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为 的空间构型为
的空间构型为(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是
 |  | 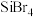 |  | |
| 沸点/K | 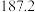 | 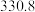 | 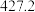 | 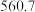 |
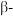 石英是晶质石英(
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为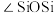 并不是
并不是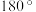 的原因是
的原因是
更新时间:2023-06-24 13:45:33
|
相似题推荐
【推荐1】铜是人类最早发现的金属之一,是人类广泛使用的一种金属。
I.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
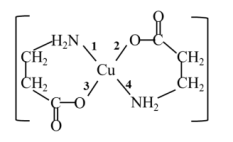
(1)基态Cu2+的最外层电子排布式为___ 。
(2)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是___ 。
(3)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是__ (填写编号)。
II.硫酸四氨合铜在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物,在碱性镀铜中也常用作电镀液的主要成分。某同学在实验室制备硫酸四氨合铜,过程如图:
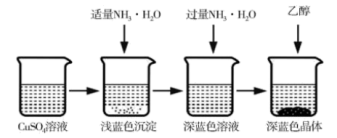
(4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式____ 。
(5)加入乙醇后,硫酸四氨合铜析出的原因是___ 。
Ⅲ.常用电解法制备Cu2O
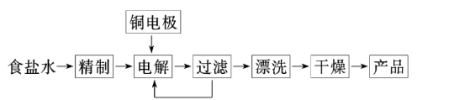
已知:①Cu2O为暗红色的固体,有毒;②部分难溶物的颜色和常温下的Ksp如表所示:
实验室模拟电解装置如图所示,观察到的现象如图:
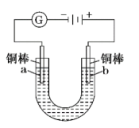
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显红色。则:
(6)电解池的阳极反应式为___ 。
(7)电极b极附近的白色沉淀开始变成黄色,此时溶液中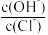 =
=__ 。
I.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:

(1)基态Cu2+的最外层电子排布式为
(2)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是
(3)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是
II.硫酸四氨合铜在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物,在碱性镀铜中也常用作电镀液的主要成分。某同学在实验室制备硫酸四氨合铜,过程如图:

(4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式
(5)加入乙醇后,硫酸四氨合铜析出的原因是
Ⅲ.常用电解法制备Cu2O

已知:①Cu2O为暗红色的固体,有毒;②部分难溶物的颜色和常温下的Ksp如表所示:
| 难溶物 | Cu(OH)2 | CuOH | CuCl | Cu2O |
| 颜色 | 蓝色 | 黄色 | 白色 | 红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | — |
实验室模拟电解装置如图所示,观察到的现象如图:

①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显红色。则:
(6)电解池的阳极反应式为
(7)电极b极附近的白色沉淀开始变成黄色,此时溶液中
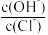 =
=
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】已知周期表前四周期的元素a、b、c、d、e、f原子序数依次增大。a的核外电子总数与其周期数相同,c原子的最外层电子数是内层电子数的3倍,b、c左右相邻,c与d同族,e元素正三价离子的3d能级为半充满,f原子的次外层全充满,最外层只有一个电子。请回答下列问题:
(1)元素e的原子核外共有______ 种不同运动状态的电子,有_____ 种不同能级的电子。
(2)实验室中制备ba3的化学方程式为____ ,产生的ba3与a2d比较,键角更大的是____ ,原因是_____ 。
(3)f晶胞为面心立方最密堆积,其空间利用率为________ ,由d、e、f组成的物质晶胞结构如图。

①该物质的化学式为___________ 。
②以该物质为原料炼f过程中,会产生d的低价氧化物,该d的低价氧化物分子空间构型为___________ ,与其互为等电子体的阴离子有___________ 。
(4)由a、b、c、d四种元素可组成两种酸式盐M和N,请写出M和N之间反应的离子方程式___________ 。
(1)元素e的原子核外共有
(2)实验室中制备ba3的化学方程式为
(3)f晶胞为面心立方最密堆积,其空间利用率为

①该物质的化学式为
②以该物质为原料炼f过程中,会产生d的低价氧化物,该d的低价氧化物分子空间构型为
(4)由a、b、c、d四种元素可组成两种酸式盐M和N,请写出M和N之间反应的离子方程式
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅原子电子占据的最高能层符号是_____ ,其中能量最高的电子所占据能级的原子轨道有_____ 个伸展方向,原子轨道呈_____ 形。
(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有____________ 。
(3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为________ (用元素符号表示)。H2SeO3的酸性_______ H2SeO4(填“强于”或“弱于”),原因是___________ (从分子结构的角度回答)。
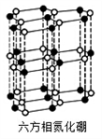
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如下左图所示。六方相氮化硼______ π键(填“含有”或“不含”),其质地软的原因是_________ 。NaBH4是一种重要的储氢载体,阴离子的的立体结构为_______ 。
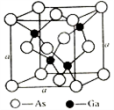
(5)砷化镓是优良的第三代半导体材料。如上图所示为GaAs的晶胞结构。
①与GaAs互为等电子体的一种原子晶体的化学式为________ 。
②已知晶胞的密度是ρ g·cm−3,阿伏伽德罗常数值为NA,棱长a=_____ pm。
(1)基态硅原子电子占据的最高能层符号是
(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
(3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如下左图所示。六方相氮化硼

(5)砷化镓是优良的第三代半导体材料。如上图所示为GaAs的晶胞结构。
①与GaAs互为等电子体的一种原子晶体的化学式为
②已知晶胞的密度是ρ g·cm−3,阿伏伽德罗常数值为NA,棱长a=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】前四周期元素及其化合物在生产、生活中应用广泛。回答下列问题:
(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是_______ 。
a. b.
b. c.
c. d.
d.
(2)基态铜原子的价电子排布式为_______ 。
(3) 的几何构型为
的几何构型为_______ , 中含有的价层电子对数目为
中含有的价层电子对数目为_______ 。
(4)已知下图均与第三周期的主族元素有关。
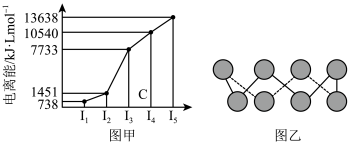
①图甲表示第一至第五电离能数据,则该元素的原子有_______ 种不同运动状态的电子。
②图乙中为某单质的一种同素异形体,分子中的各原子最外层均达到8电子稳定结构,则该元素的原子的杂化轨道类型为_______ ,其易溶于 的原因是
的原因是_______ 。
(5)氨气极易溶于水,溶于水的氨分子大部分与水分子形成氢键,生成一水合氨,关于一水合氨的结构有如下两种可能,正确的是b,理由是_______ 。

(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是
a.
 b.
b. c.
c.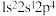 d.
d.
(2)基态铜原子的价电子排布式为
(3)
 的几何构型为
的几何构型为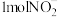 中含有的价层电子对数目为
中含有的价层电子对数目为(4)已知下图均与第三周期的主族元素有关。

①图甲表示第一至第五电离能数据,则该元素的原子有
②图乙中为某单质的一种同素异形体,分子中的各原子最外层均达到8电子稳定结构,则该元素的原子的杂化轨道类型为
 的原因是
的原因是(5)氨气极易溶于水,溶于水的氨分子大部分与水分子形成氢键,生成一水合氨,关于一水合氨的结构有如下两种可能,正确的是b,理由是

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】中国科学院福建物质结构研究所合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料 ,并获得了该化合物的LED器件。回答下列问题:
,并获得了该化合物的LED器件。回答下列问题:
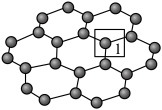
(1)石墨烯(如图所示)是一种由单层碳原子构成的平面结构新型碳材料,其中C原子的杂化方式为_______ ,1号碳原子与相邻碳原子形成的键角为_______ 。 分子中,B原子与3个羟基相连,B原子的杂化轨道类型是
分子中,B原子与3个羟基相连,B原子的杂化轨道类型是_______ ,将“—OH”视为一个原子,硼酸分子的空间结构为_______ ; 中,B原子的杂化轨道类型为
中,B原子的杂化轨道类型为_______ ,其中一个B—O键是配位键,孤电子对由_______ (填元素符号)原子提供。
(3)硼与第VA族元素组成的化合物氮化硼(BN)、磷化硼(BP)、砷化硼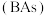 的晶体结构与单晶硅相似。其中氮化硼(BN)和磷化硼(BP)是受到高度关注的耐磨涂料,砷化硼
的晶体结构与单晶硅相似。其中氮化硼(BN)和磷化硼(BP)是受到高度关注的耐磨涂料,砷化硼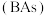 是一种超高热导率半导体材料。
是一种超高热导率半导体材料。
①BN晶体的熔点要比BP晶体的熔点高,其原因是_______ 。
② 的晶胞结构如图所示,已知阿伏加德罗常数的值为
的晶胞结构如图所示,已知阿伏加德罗常数的值为 ,若晶胞中B原子到As原子最近距离为apm,则该晶体的密度
,若晶胞中B原子到As原子最近距离为apm,则该晶体的密度
_______  (列出含a、
(列出含a、 的计算式即可)。
的计算式即可)。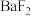 晶体是面心立方结构,其晶胞结构如图所示,晶胞中每个
晶体是面心立方结构,其晶胞结构如图所示,晶胞中每个 周围距离相等且最近的
周围距离相等且最近的 有
有_______ 个。
 ,并获得了该化合物的LED器件。回答下列问题:
,并获得了该化合物的LED器件。回答下列问题:(1)石墨烯(如图所示)是一种由单层碳原子构成的平面结构新型碳材料,其中C原子的杂化方式为
 分子中,B原子与3个羟基相连,B原子的杂化轨道类型是
分子中,B原子与3个羟基相连,B原子的杂化轨道类型是 中,B原子的杂化轨道类型为
中,B原子的杂化轨道类型为(3)硼与第VA族元素组成的化合物氮化硼(BN)、磷化硼(BP)、砷化硼
 的晶体结构与单晶硅相似。其中氮化硼(BN)和磷化硼(BP)是受到高度关注的耐磨涂料,砷化硼
的晶体结构与单晶硅相似。其中氮化硼(BN)和磷化硼(BP)是受到高度关注的耐磨涂料,砷化硼 是一种超高热导率半导体材料。
是一种超高热导率半导体材料。①BN晶体的熔点要比BP晶体的熔点高,其原因是
②
 的晶胞结构如图所示,已知阿伏加德罗常数的值为
的晶胞结构如图所示,已知阿伏加德罗常数的值为 ,若晶胞中B原子到As原子最近距离为apm,则该晶体的密度
,若晶胞中B原子到As原子最近距离为apm,则该晶体的密度
 (列出含a、
(列出含a、 的计算式即可)。
的计算式即可)。
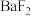 晶体是面心立方结构,其晶胞结构如图所示,晶胞中每个
晶体是面心立方结构,其晶胞结构如图所示,晶胞中每个 周围距离相等且最近的
周围距离相等且最近的 有
有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】铜和钛可呈现多种化合价,回答下列问题。
(1)配位化合物中心原子也存在轨道杂化现象,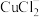 中
中 采取sp杂化,
采取sp杂化,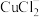 的空间结构为
的空间结构为___________ 。
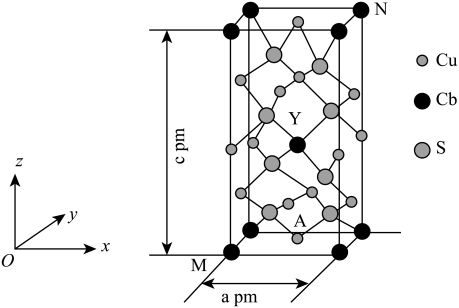
(2)某种含铜热电材料,晶胞结构如图,Cu位于棱、面上,Sb位于体心、顶点,S位于晶胞内,底部边长为 ,高为
,高为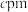 ,该晶体化学式为
,该晶体化学式为___________ ,其中部分原子坐标为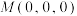 、
、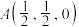 、
、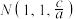 ,Y点的原子坐标为
,Y点的原子坐标为___________ 。
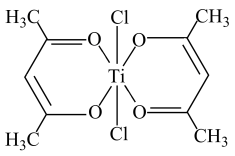
(3)基态Ti原子的价电子轨道表示式为___________ 。
(4)钛基配合物可用于催化环烯烃聚合,其结构如图所示:
钛的配位数为___________ 。
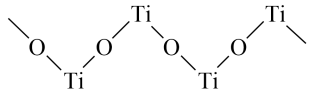
(5)已知 与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为
与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为___________ 。
(1)配位化合物中心原子也存在轨道杂化现象,
 中
中 采取sp杂化,
采取sp杂化,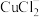 的空间结构为
的空间结构为(2)某种含铜热电材料,晶胞结构如图,Cu位于棱、面上,Sb位于体心、顶点,S位于晶胞内,底部边长为
 ,高为
,高为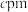 ,该晶体化学式为
,该晶体化学式为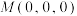 、
、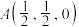 、
、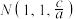 ,Y点的原子坐标为
,Y点的原子坐标为
(3)基态Ti原子的价电子轨道表示式为
(4)钛基配合物可用于催化环烯烃聚合,其结构如图所示:

钛的配位数为
(5)已知
 与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为
与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】已知元素N、S、 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
(1)Se与S是同族元素,请写出基态Se原子的电子排布式:__ 。N与S是不同族元素,请解释NH3在水中的溶解度比H2S大的原因:__ 。
(2)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__ 。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__ 。
(3)已知 的结构为
的结构为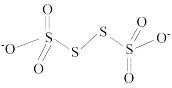 其中S原子的杂化方式是
其中S原子的杂化方式是__ 。
(4)N、P可分别形成多种三角锥形分子,已知NH3的键角大于PH3,原因是__ 。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为__ ,晶体的密度为__ g/cm3(列出计算式,无需化简,设NA为阿伏加 德罗常数的值)。
 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:(1)Se与S是同族元素,请写出基态Se原子的电子排布式:
(2)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为
(3)已知
 的结构为
的结构为 其中S原子的杂化方式是
其中S原子的杂化方式是(4)N、P可分别形成多种三角锥形分子,已知NH3的键角大于PH3,原因是
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
| 半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
| 典型化学式 | 立方ZnS | NaCl | CsCl |
| 晶胞 | 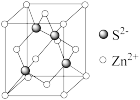 | 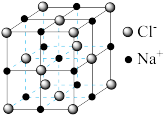 | 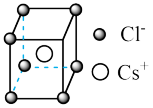 |
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为___________ ;
(2)已知 具有对称的空间构型,
具有对称的空间构型, 中的两个
中的两个 被
被 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为___________ ; 还可形成
还可形成 ,其中
,其中 代表
代表 。该配合物中,
。该配合物中, 模型为四面体的非金属原子共有
模型为四面体的非金属原子共有___________ 个。
(3)一种由 、
、 、
、 组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为 ,晶体中
,晶体中 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如 点,
点, 点原子的分数坐标分别为
点原子的分数坐标分别为 、
、 ,则
,则 点原子的分数坐标为
点原子的分数坐标为___________ ,晶胞中 、
、 间距离
间距离
___________  。
。 是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价
是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价 原子)。
原子)。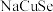 晶胞中0价
晶胞中0价 原子个数为
原子个数为___________ ,每个 晶胞完全转化为
晶胞完全转化为 晶胞,转移电子数为
晶胞,转移电子数为___________ 。
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为(2)已知
 具有对称的空间构型,
具有对称的空间构型, 中的两个
中的两个 被
被 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为 还可形成
还可形成 ,其中
,其中 代表
代表 。该配合物中,
。该配合物中, 模型为四面体的非金属原子共有
模型为四面体的非金属原子共有(3)一种由
 、
、 、
、 组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为 ,晶体中
,晶体中 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为 点,
点, 点原子的分数坐标分别为
点原子的分数坐标分别为 、
、 ,则
,则 点原子的分数坐标为
点原子的分数坐标为 、
、 间距离
间距离
 。
。
 是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价
是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价 原子)。
原子)。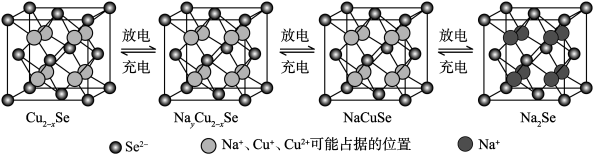
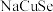 晶胞中0价
晶胞中0价 原子个数为
原子个数为 晶胞完全转化为
晶胞完全转化为 晶胞,转移电子数为
晶胞,转移电子数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有___________ 个未成对电子,基态Fe的电子排布式为___________ ,可用硫氰化钾检验Fe3+,形成的配合物的颜色为___________ 。
(3)甲醇催化氧化可得甲醛,甲醛与新制Cu(OH)2碱性溶液反应生成Cu2O沉淀。
① 甲醇的沸点比甲醛的高,其主要原因是___________ ;甲醛分子中碳原子的杂化类型为___________ 。
② 甲醛分子的空间构型是___________ ;1 mol甲醛分子中σ键的数目为___________ 。
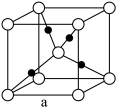
③Cu2O晶胞中结构如图所示。该晶体的密度为d g/cm3,设阿伏加德罗常数的值为NA,则该晶胞的体积为___________ cm3。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
| A.观察自范性 | B.观察各向异性 | C.测定固定熔点 | D.进行X-射线衍射实验 |
(3)甲醇催化氧化可得甲醛,甲醛与新制Cu(OH)2碱性溶液反应生成Cu2O沉淀。
① 甲醇的沸点比甲醛的高,其主要原因是
② 甲醛分子的空间构型是
③Cu2O晶胞中结构如图所示。该晶体的密度为d g/cm3,设阿伏加德罗常数的值为NA,则该晶胞的体积为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】Ⅰ.硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是___________ ,最高能级电子所在的原子轨道为___________ 形。
(2)①硫单质的一种结构为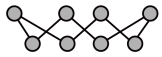 ,S原子杂化方式为
,S原子杂化方式为___________ ; 分子的空间构型是
分子的空间构型是___________ 。
② 、
、 、
、 键角由大到小的顺序是
键角由大到小的顺序是___________ 。
③比较沸点高低: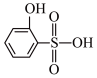
___________ (填“>”或“<”)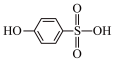 。
。
(3)Fe位于周期表的___________ 区,基态Fe原子的核外电子有___________ 种空间运动状态,Fe与CO形成的化合物Fe(CO)5常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于___________ (填晶体类型)。
(4)ZnS晶胞如图所示:
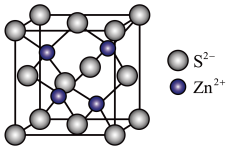
①由图可知,每个 周围与它最接近且距离相等的
周围与它最接近且距离相等的 有
有___________ 个。
②已知该晶胞密度为 ,阿伏加德罗常数为NA,则晶胞边长为
,阿伏加德罗常数为NA,则晶胞边长为___________ pm。
(学法题)根据所学知识分析归纳,计算晶体密度的关键是___________
(5)早在西汉时期的《淮南万毕术》中记载“曾青得铁则化为铜”,这是有关“湿法炼铜”最早文献记录。若向盛有硫酸铜的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。
①写出蓝色沉淀溶解的离子方程式___________ ;
②若向该深蓝色透明溶液中加入溶剂___________ ,将有深蓝色晶体析出,写出该晶体的化学式___________ 。
(1)基态硫原子的价层电子排布图是
(2)①硫单质的一种结构为
 ,S原子杂化方式为
,S原子杂化方式为 分子的空间构型是
分子的空间构型是②
 、
、 、
、 键角由大到小的顺序是
键角由大到小的顺序是③比较沸点高低:

 。
。(3)Fe位于周期表的
(4)ZnS晶胞如图所示:

①由图可知,每个
 周围与它最接近且距离相等的
周围与它最接近且距离相等的 有
有②已知该晶胞密度为
 ,阿伏加德罗常数为NA,则晶胞边长为
,阿伏加德罗常数为NA,则晶胞边长为(学法题)根据所学知识分析归纳,计算晶体密度的关键是
(5)早在西汉时期的《淮南万毕术》中记载“曾青得铁则化为铜”,这是有关“湿法炼铜”最早文献记录。若向盛有硫酸铜的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。
①写出蓝色沉淀溶解的离子方程式
②若向该深蓝色透明溶液中加入溶剂
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】据《中国日报网》报道:美国OakRidge国家实验室研究人员意外发现了用Cu—Si—C作催化剂,在电催化下CO2与水可直接转化为C2H5OH和O2。回答下列问题:
(1)基态铜原子核外电子排布式为___ ,有__ 个未成对电子。
(2)Cu、Si、C的电负性由大到小的顺序为___ 。
(3)C2H5OH与二甲醚(CH3OCH3)摩尔质量相同,但C2H5OH的沸点高于CH3OCH3,其原因是___ 。
(4)CO2的空间构型为__ ,其中C的杂化方式为___ 。
(5)比较下列硅的卤化物的熔点和沸点,分析其变化规律及原因:___ 。
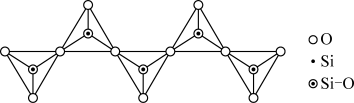
(6)如图为一种无限长单链结构的多硅酸根,其化学式为___ 。
(7)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,该晶胞中有___ 个铜原子,若晶胞参数为a=0.427nm,则该晶体的密度为___ g·cm-3(列出计算式即可)。
(1)基态铜原子核外电子排布式为
(2)Cu、Si、C的电负性由大到小的顺序为
(3)C2H5OH与二甲醚(CH3OCH3)摩尔质量相同,但C2H5OH的沸点高于CH3OCH3,其原因是
(4)CO2的空间构型为
(5)比较下列硅的卤化物的熔点和沸点,分析其变化规律及原因:
| 硅的卤化物 | SiCl4 | SiBr4 | SiI4 |
| 熔点/℃ | -70 | 5.4 | 120.5 |
| 沸点/℃ | 57.6 | 154 | 287.5 |

(7)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,该晶胞中有
您最近一年使用:0次
【推荐3】目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
I.硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
(1)在[Ni(NH3)6]2+中存在的化学键有_______ 。
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键 F.π键
II.丁二酮肟是检验Ni2+的灵敏试剂。
(2)丁二酮肟分子9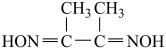 )中N原子轨道杂类型为
)中N原子轨道杂类型为_______ ,1mol丁二酮肟分子所含σ键的数目为_______ 。丁二酮肟分子在与Ni2+形成配离子时,配位原子最有可能是_____ 。
(3)配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。
①[Ni(CO)4]固态时属于_______ 晶体(填晶体类型)。
②[Ni(CO)4]中Ni与CO的C原子形成配位键。不考虑空间构型,[Ni(CO)4]的结构可用示意图表示为____ (用“→”表示出配位键) 。
III.填空。
(4)NaCNO是离子化合物,各原子均满足8电子稳定结构,NaCNO的电子式是_______ 。
(5)相同温度下,冰的密度比水小的主要原因是_______ 。
I.硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
(1)在[Ni(NH3)6]2+中存在的化学键有
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键 F.π键
II.丁二酮肟是检验Ni2+的灵敏试剂。
(2)丁二酮肟分子9
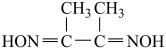 )中N原子轨道杂类型为
)中N原子轨道杂类型为(3)配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。
①[Ni(CO)4]固态时属于
②[Ni(CO)4]中Ni与CO的C原子形成配位键。不考虑空间构型,[Ni(CO)4]的结构可用示意图表示为
III.填空。
(4)NaCNO是离子化合物,各原子均满足8电子稳定结构,NaCNO的电子式是
(5)相同温度下,冰的密度比水小的主要原因是
您最近一年使用:0次



