解题方法
1 . 回答下列问题
(1)选择题(题目给出的四个选项中,有两个 选项是符合题目要求的)下列关于晶体的说法中,不正确 的是_____
(2)黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:2CuFeS2 + O2 = Cu2S + 2FeS + SO2。
①Fe在周期表中的位置为_______ ;Fe、S、O原子的第一电离能由大到小的顺序是_______ 。
②Cu元素的基态原子的电子排布式为_______ ,有_______ 个未成对电子。
③SO2分子的立体构型为_______ ,SO2可氧化生成SO3,SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______ 。

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因_______ 。
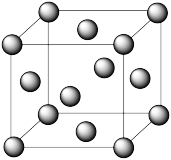
⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有_______ 个,晶胞的边长为_______ (用含ρ和NA的式子表示)。
(1)选择题(题目给出的四个选项中,有
| A.MgO的晶格能远比NaCl大,这是因为前者粒子所带的电荷多,粒子半径小 |
| B.第一电离能:Cl>S>P>Si |
| C.金属原子在二维平面里放置得到非密置层和密置层两种方式,配位数分别为4和6 |
| D.共价键可决定分子晶体的熔、沸点 |
①Fe在周期表中的位置为
②Cu元素的基态原子的电子排布式为
③SO2分子的立体构型为

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因

⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有
您最近一年使用:0次
解题方法
2 . X、Y、Z、W、M、N、R是原子序数依次增大的前四周期元素,基态M原子的电子填充了3个能级,其中有2个未成对电子,N的最高正价与最低负价的代数和为6,基态R2+的d轨道半充满。由上述元素中的五种组成的某多孔储氢材料前驱体结构如图所示。

回答下列问题:
(1)基态Y原子的价电子排布图为_______ ,其中电子占据最高能级的电子云轮廓图为_______ 形;第一电离能介于Y和M之间的同周期元素有_______ 种。
(2)键角比较:
_______  (填“>”或“<”),理由是
(填“>”或“<”),理由是_______ 。
(3) R2+能形成配离子为八面体的配合物RNm∙nWX3,在该配合物中, 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配离子的化学式为
溶液反应可生成71.75g白色沉淀,则该配离子的化学式为_______ ;该配合物中心原子的价层电子对数为_______ ;下列对该配合物中心原子杂化方式推断合理的是_______ (填标号)。
a. b.
b. c.
c. d.
d.

回答下列问题:
(1)基态Y原子的价电子排布图为
(2)键角比较:

 (填“>”或“<”),理由是
(填“>”或“<”),理由是(3) R2+能形成配离子为八面体的配合物RNm∙nWX3,在该配合物中,
 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配离子的化学式为
溶液反应可生成71.75g白色沉淀,则该配离子的化学式为a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2022-09-05更新
|
383次组卷
|
2卷引用:山东省临沂市2022-2023学年高三上学期开学摸底考试化学试题
名校
解题方法
3 . 主族元素N、F、Si、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于_______ 晶体;SiCl4中Si采取的杂化类型为_______ 。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点低于Cl2O,原因是_______ 。
(3)Se元素基态原子的原子核外电子排布式为_______ ;As的第一电离能比Se的第一电离能大的原因为_______ 。
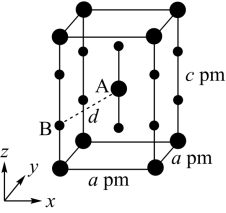
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ ;晶胞中A、B间距离d=_______ pm。
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于
(2)O、F、Cl电负性由大到小的顺序为
(3)Se元素基态原子的原子核外电子排布式为
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2022-05-02更新
|
860次组卷
|
7卷引用:四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题
四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
21-22高三上·广东广州·期末
名校
4 . 回答下列问题:
(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。回答下列问题:
①基态锌原子的电子排布式为___ ,原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为___ 。
②Cd与Zn同族,价电子数相同,若配离子[Cd(CN)x](x-2)-的中心离子价电子数与配体提供的电子数之和为18,则x=____ 。
③碲和硫同主族,TeO 的空间构型为
的空间构型为___ ,写出一个与TeO 互为等电子体的分子
互为等电子体的分子___ 。
(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。1mol石墨烯含六元环的数目为___ ;石墨烯中部分碳原子被氧化后,其平面结构将发生改变,转化为氧化石墨烯(如图),氧化石墨烯中键角α___ (填“>”、“<”或“=”)键角β,原因是___ 。
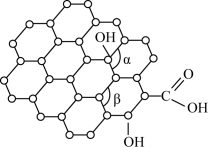
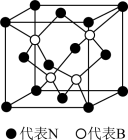
(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,B原子填在由N原子构成的___ (填“四面体”、“八面体”或“立方体”)空隙中。若晶胞边长为apm,B原子半径为bpm,N原子半径为cpm,则该晶胞的空间利用率为____ (列出计算式),氮硼原子间的最短距离为___ pm。
(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。回答下列问题:
①基态锌原子的电子排布式为
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为②Cd与Zn同族,价电子数相同,若配离子[Cd(CN)x](x-2)-的中心离子价电子数与配体提供的电子数之和为18,则x=
③碲和硫同主族,TeO
 的空间构型为
的空间构型为 互为等电子体的分子
互为等电子体的分子(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。1mol石墨烯含六元环的数目为

(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,B原子填在由N原子构成的

您最近一年使用:0次
2022-01-23更新
|
612次组卷
|
4卷引用:广东名校2021-2022学年高三下学期开学测试化学试题
广东名校2021-2022学年高三下学期开学测试化学试题(已下线)广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题湖南省长沙市雅礼中学2021-2022学年高三下学期月考(七)化学试题湖南省娄底市2022届高三上学期第二次模拟考试化学试题
名校
解题方法
5 . “嫦娥五号”首次实现了我国地外天体采样返回,它的成功发射标志着我国航天技术向前迈出了一大步,其制作材料中包含了Cu、Ti、 Cr、Ni、Mo、N、O等多种元素。回答下列问题:
(1)Mo位于Cr同一副族的相邻下一周期,则基态Mo原子的外围电子排布式为___________ ;基态Mo3+最高能层中成对电子与单电子的数目比为 ___________ 。
(2)Cu催化烯烃硝化反应过程中会产生NO 。键角: NO
。键角: NO
___________ NO (填“>”或“<”),其原因是
(填“>”或“<”),其原因是___________ 。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。CuCl2可与某有机物形成具有较强荧光性能的配合物,其结构如图1所示,1mol该配合物中通过螯合作用形成的配位键有___________ mol, 该螯合物中N的杂化方式为___________ 。

(4)五水合硫酸铜(化学式CuSO4·5H2O)海裕称蓝矾或胆矾,结构如图2所示,其中存在的化学键有___________ 填选项字母)
A.离子键 B.共价键 C. 金属键 D.配位键 E.氢键
(5)过渡金属与CO形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物Ni(CO)X中,x=___________ 。
(6)磷青铜晶体的晶胞结构如图所示。原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标: A为(0, 0, 0); B为(0,1, 1); C为(1, 1, 0); 则D原子的分数坐标为___________ 。该晶体中两个距离最近的Cu原子的核间距为anm,则晶体密度为___________ g·cm-3(列出计算式, 设NA为阿伏加德罗常数的值)。

(1)Mo位于Cr同一副族的相邻下一周期,则基态Mo原子的外围电子排布式为
(2)Cu催化烯烃硝化反应过程中会产生NO
 。键角: NO
。键角: NO
 (填“>”或“<”),其原因是
(填“>”或“<”),其原因是(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。CuCl2可与某有机物形成具有较强荧光性能的配合物,其结构如图1所示,1mol该配合物中通过螯合作用形成的配位键有

(4)五水合硫酸铜(化学式CuSO4·5H2O)海裕称蓝矾或胆矾,结构如图2所示,其中存在的化学键有
A.离子键 B.共价键 C. 金属键 D.配位键 E.氢键
(5)过渡金属与CO形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物Ni(CO)X中,x=
(6)磷青铜晶体的晶胞结构如图所示。原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标: A为(0, 0, 0); B为(0,1, 1); C为(1, 1, 0); 则D原子的分数坐标为

您最近一年使用:0次
2021-11-11更新
|
556次组卷
|
2卷引用:河南省洛阳市孟津第一中学2021--2022学年高二下学期开学测试化学(理)试题
名校
解题方法
6 . 材料是人类文明进步的阶梯,第ⅢA、ⅣA、ⅤA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态Ge原子的核外电子有__ 种不同的空间运动状态。
(2)P、S、Cl的第一电离能由大到小的顺序为__ 。
(3)M与Ga位于同周期,M3+的一种配合物组成为[M(NH3)5(H2O)]Cl3。
①下列有关NH3、H2O的说法正确的是__ (填字母)。
a.分子空间构型相同
b.中心原子杂化类型相同
c.键角大小相同
②1mol[M(NH3)5(H2O)]3+含__ 个σ键。
③配合物T与[M(NH3)5(H2O)]Cl3组成元素的种类和数目相同,中心离子的配位数相同。1molT溶于水,加入足量AgNO3溶液可生成2molAgCl。则T的化学式为___ 。
(4)如图甲为硼酸晶体的片层结构,其中硼的杂化方式为__ 。H3BO3在热水中比冷水中溶解度显著增大的主要原因是__ 。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图乙所示,该晶胞中B原子相连构成几何体的空间构型为__ (填“立方体”或“正四面体”或“正八面体”)。已知该晶体的密度为ρg·cm-3,NA是阿伏加 德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为__ pm(列式即可)。

(1)基态Ge原子的核外电子有
(2)P、S、Cl的第一电离能由大到小的顺序为
(3)M与Ga位于同周期,M3+的一种配合物组成为[M(NH3)5(H2O)]Cl3。
①下列有关NH3、H2O的说法正确的是
a.分子空间构型相同
b.中心原子杂化类型相同
c.键角大小相同
②1mol[M(NH3)5(H2O)]3+含
③配合物T与[M(NH3)5(H2O)]Cl3组成元素的种类和数目相同,中心离子的配位数相同。1molT溶于水,加入足量AgNO3溶液可生成2molAgCl。则T的化学式为
(4)如图甲为硼酸晶体的片层结构,其中硼的杂化方式为
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图乙所示,该晶胞中B原子相连构成几何体的空间构型为

您最近一年使用:0次
2020-06-12更新
|
187次组卷
|
2卷引用:吉林省延边第二中学2022-2023学年高三上学期开学调研考试化学试题



