解题方法
1 . 氮气来源广泛且转化生成的工业产品(如氨、肼类等)具有重要的社会效益和经济价值。我国科学家成功制备了一类以金属锌为中心离子、具有双氮负离子配位和稳定D-A-D夹心结构的多孔金属配位聚合物材料NJUZ-1.NJUZ-1双氮配位聚合物具有优异的固氮性能。能够将空气中的氮气经光催化还原为氮。
(1)氨分子的空间构型为___________ 。
(2)光催化固氮在NJUZ-1催化剂作用下的反应机理如下(*表示吸附态)
①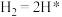
②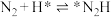 ;
;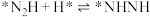 ;
;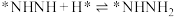 ;
;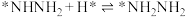 ;
;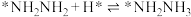 ;
;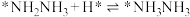
③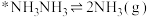
已知断裂1mol相应化学键需要的能量如下
写出光催化固氮在NJUZ-1催化剂作用下总反应的热化学方程式___________ 。
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应: ΔH<0
ΔH<0
请完成下列问题:
①试比较化学平衡常数K1、K2的大小,K1___________ K2(填“>”、“<”或“=”)
②400℃时,反应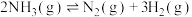 的化学平衡常数为
的化学平衡常数为___________ 。当NH3、N2和H2的物质的量分别为2mol、amol和1mol时,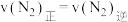 。a=
。a=___________ 。
③采用NJUZ-1将空气中的氮气经光催化还原为氨时需要将N2纯化,目的是___________ 。
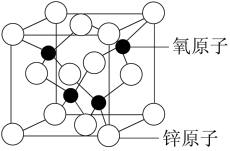
(4)氧化锌是制备NJUZ-1的重要原料之一,其结构有很多种,其中一种立方晶胞结构如图所示,Zn2+的配位数为___________ ;Zn2+周围等距且最近的Zn2+数为___________ 。
(1)氨分子的空间构型为
(2)光催化固氮在NJUZ-1催化剂作用下的反应机理如下(*表示吸附态)
①
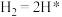
②
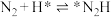 ;
;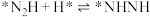 ;
;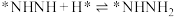 ;
;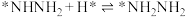 ;
;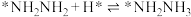 ;
;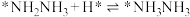
③
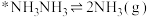
已知断裂1mol相应化学键需要的能量如下
| 化学键 |  |  |  |
| 能量 | 436kJ | 391kJ | 946kJ |
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
 ΔH<0
ΔH<0请完成下列问题:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,反应
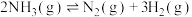 的化学平衡常数为
的化学平衡常数为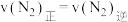 。a=
。a=③采用NJUZ-1将空气中的氮气经光催化还原为氨时需要将N2纯化,目的是
(4)氧化锌是制备NJUZ-1的重要原料之一,其结构有很多种,其中一种立方晶胞结构如图所示,Zn2+的配位数为

您最近一年使用:0次
名校
解题方法
2 . Co元素的某些化合物在电池、光电材料、催化剂等方面有广泛应用。回答下列问题:
(1)一种具有光催化作用的配合物A结构简式如图所示:
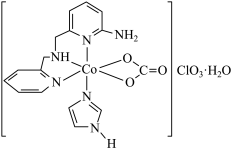
①基态Co原子价电子排布图为___________ 。
②外界 的空间构型为
的空间构型为___________ ,钴元素价态为___________ 。
③配合物A配位数为___________ ,中心离子的杂化方式为___________ (填标号)。
A.sp3 B.dsp2 C.d2sp3 D.sp3d
④咪唑( )具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是
)具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是_________ 。
(2)Co的一种化合物为六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数体标。

已知晶胞含对称中心,其中1号氧原子的分数坐标为(0.6667,0.6667,0.6077),则2号氧原子的分数坐标为___________ ;NA为阿伏加德罗常数的值,该晶体的密度为___________ g/cm3(用计算式表示)。
(1)一种具有光催化作用的配合物A结构简式如图所示:

①基态Co原子价电子排布图为
②外界
 的空间构型为
的空间构型为③配合物A配位数为
A.sp3 B.dsp2 C.d2sp3 D.sp3d
④咪唑(
 )具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是
)具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是(2)Co的一种化合物为六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数体标。

已知晶胞含对称中心,其中1号氧原子的分数坐标为(0.6667,0.6667,0.6077),则2号氧原子的分数坐标为
您最近一年使用:0次
2024-01-29更新
|
489次组卷
|
2卷引用:2023届宁夏回族自治区石嘴山市第三中学高三下学期第三次模拟考试理综试题
名校
3 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚来诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领城引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如图:
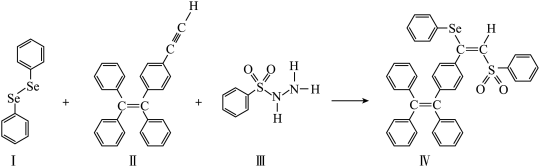
(1)Se与S同族,基态硒价电子排布简式为_______ ,基态Se原子核外电子有_______ 种空间运动状态不同的电子。
(2)H2Se的沸点低于H2O,其原因是_______ 。
(3)关于上图4种物质,下列说法正确的有_______ 。
A. Ⅰ中仅有 键
键
B. Ⅰ中的Se-Se键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有sp与sp3
E. Ⅰ~Ⅲ含有的元素中,O电负性最大
F.Ⅳ中具有孤对电子的原子只有O
(4)酸性强弱H2SeO4_______ H2SeO3(填“>”或“<"), 的立体构型为
的立体构型为_______ 。
(5)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。

①X的化学式为_______ 。
②设X的最简式的式量为Mr,晶体密度为ρg/cm3,则X中相邻K之间的最短距离为_______ nm((列出计算式,NA为阿伏加德罗常数的值)。

(1)Se与S同族,基态硒价电子排布简式为
(2)H2Se的沸点低于H2O,其原因是
(3)关于上图4种物质,下列说法正确的有
A. Ⅰ中仅有
 键
键B. Ⅰ中的Se-Se键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有sp与sp3
E. Ⅰ~Ⅲ含有的元素中,O电负性最大
F.Ⅳ中具有孤对电子的原子只有O
(4)酸性强弱H2SeO4
 的立体构型为
的立体构型为(5)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。

①X的化学式为
②设X的最简式的式量为Mr,晶体密度为ρg/cm3,则X中相邻K之间的最短距离为
您最近一年使用:0次
名校
解题方法
4 . 我国将镓列为战略储备金属,我国的镓储量占世界储量的80%以上。请回答:
(1)基态镓原子最外层的电子排布图为________ ,最高能级的电子云形状为_________ 。
(2)镓可与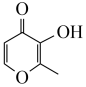 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga(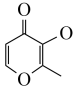 )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是___________ (填名称);每个甲基麦芽酚分子中含有___________ 个σ键。
(3)镓的卤化物熔点如表所示:
①氯化镓中镓的杂化方式与下列微粒的中心原子的杂化方式相同且氯化镓的空间结构也与其微粒相同的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
②各物质的熔点从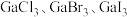 到
到 依次升高,原因是
依次升高,原因是___________ 。
(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以___________ 键结合。
(1)基态镓原子最外层的电子排布图为
(2)镓可与
 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga( )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是(3)镓的卤化物熔点如表所示:
| 物质 |  |  |  |  |
| 熔点/℃ | 1000 | 78 | 124 | 213 |
A.
 B.
B. C.
C. D.
D.
②各物质的熔点从
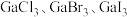 到
到 依次升高,原因是
依次升高,原因是(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以
您最近一年使用:0次
名校
解题方法
5 . 甲硅烷 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。
(1) 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
___________ H(填“>”“<”或“=”), 分子的空间结构为
分子的空间结构为___________ 。
(2)利用 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。

①碳化硅晶体中每个 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为________ , 的晶体类型是
的晶体类型是_______ 。
②基态 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为___________ 。
(3)利用 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。
①热稳定性:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
② 中
中 的键角
的键角___________  中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。(1)
 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
 分子的空间结构为
分子的空间结构为(2)利用
 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
①碳化硅晶体中每个
 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为 的晶体类型是
的晶体类型是②基态
 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为(3)利用
 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。①热稳定性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②
 中
中 的键角
的键角 中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是
您最近一年使用:0次
解题方法
6 . 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄( )褪色的主要原因是发生了以下两种化学反应:
)褪色的主要原因是发生了以下两种化学反应:
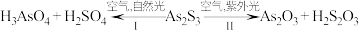
下列说法错误的是
 )褪色的主要原因是发生了以下两种化学反应:
)褪色的主要原因是发生了以下两种化学反应: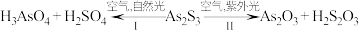
下列说法错误的是
A. 和 和 的空间构型都是正四面体形 的空间构型都是正四面体形 |
| B.反应Ⅰ和Ⅱ中均有两种氧化产物 |
C.反应Ⅰ和Ⅱ中,氧化1  转移的电子数之比为7∶3 转移的电子数之比为7∶3 |
D.反应Ⅰ和Ⅱ中,参加反应 的比值:反应Ⅰ 的比值:反应Ⅰ 反应Ⅱ 反应Ⅱ |
您最近一年使用:0次
名校
解题方法
7 . 二茂铁(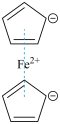 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
(1)Fe在周期表中的___________ 区,Fe变为Fe2+时是失去___________ 轨道电子;若受热后Fe的1个4s电子会跃迁至4p轨道,写出Fe的该激发态电子排布式:[Ar]___________ 。
(2)羰基铁粉【Fe(CO)5】中铁元素的配位数是___________ ,配位原子为___________ 。
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为___________ ;H3O+中氧原子的杂化方式为___________ ,H3O+空间构型为___________ 。
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每 个碳原子被一个由四个碳原子组成的正四面体结构单元( )所取代(如图乙)。
)所取代(如图乙)。

一个T-碳晶胞中含有___________ 个碳原子,已知T-碳的密度约为金刚石的一半。则T-碳晶胞的边长和金刚石晶胞的边长之比为___________ 。
 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。(1)Fe在周期表中的
(2)羰基铁粉【Fe(CO)5】中铁元素的配位数是
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每 个碳原子被一个由四个碳原子组成的正四面体结构单元(
 )所取代(如图乙)。
)所取代(如图乙)。
一个T-碳晶胞中含有
您最近一年使用:0次
名校
解题方法
8 . A~E是周期表中1~36号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多。
(1)基态B原子的价电子中,两种自旋状态的电子数之比为___________ 。 中C原子的杂化方式为
中C原子的杂化方式为___________ 。
(2)已知元素的电负性:C>D,则C与D形成的化合物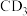 的空间构型为
的空间构型为___________ ,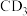 与水发生水解反应的化学方程式为
与水发生水解反应的化学方程式为___________ 。
(3)E位于元素周期表的___________ 区。
(4)已知常温下 的水解常数
的水解常数 。
。
常温下,含等物质的量浓度的HBC与NaBC的混合溶液显___________ (填“酸”“碱”或“中”)性,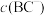
___________ (填“>”“<”或“=”)c(HBC)。常温下,若将 盐酸与
盐酸与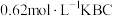 溶液等体积混合后恰好得到中性溶液,则c=
溶液等体积混合后恰好得到中性溶液,则c=___________ (小数点后保留4位数字)。
(1)基态B原子的价电子中,两种自旋状态的电子数之比为
 中C原子的杂化方式为
中C原子的杂化方式为(2)已知元素的电负性:C>D,则C与D形成的化合物
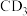 的空间构型为
的空间构型为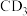 与水发生水解反应的化学方程式为
与水发生水解反应的化学方程式为(3)E位于元素周期表的
(4)已知常温下
 的水解常数
的水解常数 。
。常温下,含等物质的量浓度的HBC与NaBC的混合溶液显
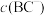
 盐酸与
盐酸与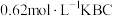 溶液等体积混合后恰好得到中性溶液,则c=
溶液等体积混合后恰好得到中性溶液,则c=
您最近一年使用:0次
2023-12-03更新
|
482次组卷
|
3卷引用:辽宁省沈阳市五校协作体2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . 我国在新材料领域的研究有重大突破,为“天宫”空间站的建设提供了物质基础。“天宫”空间站使用的材料中含有C、N、Si、P、Fe等元素。回答下列问题:
(1)基态硅原子的价电子排布式为___________ ,其基态原子核外有___________ 种不同空间运动状态的电子。
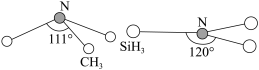
(2)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物的结构和性质存在较大差异。化合物 (三角锥形)和
(三角锥形)和 (平面形)的结构如图所示,则二者中N的杂化方式分别为
(平面形)的结构如图所示,则二者中N的杂化方式分别为___________ ,更易形成配合物的是___________ 。
(3)白磷在氯气中燃烧可以得到 和
和 ,其中气态
,其中气态 分子的空间结构为
分子的空间结构为________ 。
(4) 晶体的晶胞如图所示,晶胞边长为a nm。设
晶体的晶胞如图所示,晶胞边长为a nm。设 为阿伏加德罗常数的值,则晶体密度的计算表达式为
为阿伏加德罗常数的值,则晶体密度的计算表达式为___________  ;晶胞中
;晶胞中 位于
位于 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为___________ nm。

(1)基态硅原子的价电子排布式为
(2)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物的结构和性质存在较大差异。化合物
 (三角锥形)和
(三角锥形)和 (平面形)的结构如图所示,则二者中N的杂化方式分别为
(平面形)的结构如图所示,则二者中N的杂化方式分别为
(3)白磷在氯气中燃烧可以得到
 和
和 ,其中气态
,其中气态 分子的空间结构为
分子的空间结构为(4)
 晶体的晶胞如图所示,晶胞边长为a nm。设
晶体的晶胞如图所示,晶胞边长为a nm。设 为阿伏加德罗常数的值,则晶体密度的计算表达式为
为阿伏加德罗常数的值,则晶体密度的计算表达式为 ;晶胞中
;晶胞中 位于
位于 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次
名校
解题方法
10 . 氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。
已知:
Ⅰ.N2(g)+3H2(g) 2NH3(g) ΔH1=-92kJ•mol-1
2NH3(g) ΔH1=-92kJ•mol-1
Ⅱ.C(s)+O2(g) CO2(g) ΔH2=-394kJ•mo1-1
CO2(g) ΔH2=-394kJ•mo1-1
Ⅲ.N2(g)+3H2(g)+C(s)+O2(g) H2NCOONH4(s) ΔH3=-646kJ•mol-1
H2NCOONH4(s) ΔH3=-646kJ•mol-1
Ⅳ.H2NCOONH4(s) 2NH3(g)+CO2(g) ΔH4
2NH3(g)+CO2(g) ΔH4
回答下列问题:
(1)NH3的空间构型为________ ,NH3的键角大于PH3,分析原因为________ 。
(2)ΔH4=________ ;T℃下在某密闭容器中加入H2NCOONH4(s),假设只发生反应Ⅳ,达平衡时测得NH3的浓度为c1,保持温度不变,加压(缩小容器的体积),测得新的平衡条件下NH3的浓度为c2,则c1________ c2(填“>”“<”或“=”)。反应Ⅳ在________ (填“高温”“低温”或“任意温度”)条件下能够自发进行。
(3)某温度下在一刚性的密闭容器中,充入等物质的量N2和H2发生反应Ⅰ,起始压强为1MPa,10min末达平衡,测得平衡时压强为0.8MPa,则10min内v(N2)=________ MPa/min,此时平衡常数Kp=________ 。对于该条件下的反应,下列说法错误的是________ 。
A.当H2的体积分数不变时,说明反应已经达到化学平衡状态
B.温度升高化学反应速率加快,化学平衡常数增大
C.其他条件不变时,若适当增加N2的用量,可以提高H2的平衡转化率
D.使用合适的催化剂可以加快化学反应速率,但ΔH1不变
(4)在一定的条件下,将AmolN2和BmolH2充入某体积固定的密闭容器中合成NH3,在不同的催化剂(甲或乙)下发生反应,反应相同时间后H2的转化率与温度的关系如图:
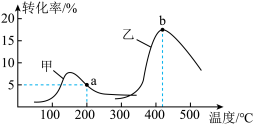
某学习小组的同学通过讨论得出结论:200℃时,a点对应的转化率(5%)不是使用催化剂甲、下H2的平衡转化率,判断依据是________ 。
已知:
Ⅰ.N2(g)+3H2(g)
 2NH3(g) ΔH1=-92kJ•mol-1
2NH3(g) ΔH1=-92kJ•mol-1Ⅱ.C(s)+O2(g)
 CO2(g) ΔH2=-394kJ•mo1-1
CO2(g) ΔH2=-394kJ•mo1-1Ⅲ.N2(g)+3H2(g)+C(s)+O2(g)
 H2NCOONH4(s) ΔH3=-646kJ•mol-1
H2NCOONH4(s) ΔH3=-646kJ•mol-1Ⅳ.H2NCOONH4(s)
 2NH3(g)+CO2(g) ΔH4
2NH3(g)+CO2(g) ΔH4回答下列问题:
(1)NH3的空间构型为
(2)ΔH4=
(3)某温度下在一刚性的密闭容器中,充入等物质的量N2和H2发生反应Ⅰ,起始压强为1MPa,10min末达平衡,测得平衡时压强为0.8MPa,则10min内v(N2)=
A.当H2的体积分数不变时,说明反应已经达到化学平衡状态
B.温度升高化学反应速率加快,化学平衡常数增大
C.其他条件不变时,若适当增加N2的用量,可以提高H2的平衡转化率
D.使用合适的催化剂可以加快化学反应速率,但ΔH1不变
(4)在一定的条件下,将AmolN2和BmolH2充入某体积固定的密闭容器中合成NH3,在不同的催化剂(甲或乙)下发生反应,反应相同时间后H2的转化率与温度的关系如图:

某学习小组的同学通过讨论得出结论:200℃时,a点对应的转化率(5%)不是使用催化剂甲、下H2的平衡转化率,判断依据是
您最近一年使用:0次



