名校
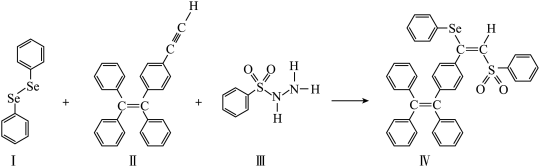
1 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚来诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如图:_______ ,基态Se原子核外电子有_______ 种空间运动状态不同的电子。
(2)H2Se的沸点低于H2O,其原因是_______ 。
(3)关于上图4种物质,下列说法正确的有_______ 。
A. Ⅰ中仅有 键
键
B. Ⅰ中的Se-Se键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有sp与sp3
E. Ⅰ~Ⅲ含有的元素中,O电负性最大
F.Ⅳ中具有孤对电子的原子只有O
(4)酸性强弱H2SeO4_______ H2SeO3(填“>”或“<"), 的立体构型为
的立体构型为_______ 。
(5)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。_______ 。
②设X的最简式的式量为Mr,晶体密度为ρg/cm3,则X中相邻K之间的最短距离为_______ nm((列出计算式,NA为阿伏加德罗常数的值)。
(2)H2Se的沸点低于H2O,其原因是
(3)关于上图4种物质,下列说法正确的有
A. Ⅰ中仅有
 键
键B. Ⅰ中的Se-Se键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有sp与sp3
E. Ⅰ~Ⅲ含有的元素中,O电负性最大
F.Ⅳ中具有孤对电子的原子只有O
(4)酸性强弱H2SeO4
 的立体构型为
的立体构型为(5)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。

②设X的最简式的式量为Mr,晶体密度为ρg/cm3,则X中相邻K之间的最短距离为
您最近一年使用:0次
名校
解题方法
2 . 二茂铁(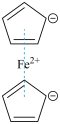 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
(1)Fe在周期表中的___________ 区,Fe变为Fe2+时是失去___________ 轨道电子;若受热后Fe的1个4s电子会跃迁至4p轨道,写出Fe的该激发态电子排布式:[Ar]___________ 。
(2)羰基铁粉【Fe(CO)5】中铁元素的配位数是___________ ,配位原子为___________ 。
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为___________ ;H3O+中氧原子的杂化方式为___________ ,H3O+空间构型为___________ 。
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每 个碳原子被一个由四个碳原子组成的正四面体结构单元( )所取代(如图乙)。
)所取代(如图乙)。

一个T-碳晶胞中含有___________ 个碳原子,已知T-碳的密度约为金刚石的一半。则T-碳晶胞的边长和金刚石晶胞的边长之比为___________ 。
 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。(1)Fe在周期表中的
(2)羰基铁粉【Fe(CO)5】中铁元素的配位数是
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每 个碳原子被一个由四个碳原子组成的正四面体结构单元(
 )所取代(如图乙)。
)所取代(如图乙)。
一个T-碳晶胞中含有
您最近一年使用:0次
名校
解题方法
3 . 锗(Ge)、碲化镉(CdTe)等是优良的半导体材料。回答下列问题:
(1)Ge在元素周期表中的位置___________ ,Ge的逐级电离能I4≪I5的原因是___________ 。
(2)经X射线衍射实验证明在碲酸( )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为___________ 。
(3)锗可以形成无机化合物 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为___________ ,锗也可以形成类似于烷烃结构的 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为___________ , 该分子中含有的
该分子中含有的 键数目为
键数目为___________ 。
(4)锗的氯化物 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是___________ , 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有___________ 个。
(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为___________ 空隙(填几何构型名称),若CdTe的摩尔质量为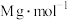 ,该晶体的密度为
,该晶体的密度为 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离___________ nm。(用含M、 、
、 的代数式表示)
的代数式表示)

(1)Ge在元素周期表中的位置
(2)经X射线衍射实验证明在碲酸(
 )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为(3)锗可以形成无机化合物
 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为 该分子中含有的
该分子中含有的 键数目为
键数目为(4)锗的氯化物
 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为
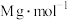 ,该晶体的密度为
,该晶体的密度为 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
名校
解题方法
4 . 金属Mn、Co、Ni、Sb等在电池、储氢材料、催化剂等方面有广泛应用。请回答下列问题:
(1)基态Co原子中,核外电子占据的最高能层的符号是_______ ,基态Ni简化的核外电子排布式为_______ 。
(2)铜锰氧化物( CuMn2O4)能在常温下催化氧化甲醛生成甲酸(结构如图)。
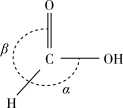
①甲酸的沸点比甲醛的_______ (填“低”或“高”),主要原因是_______ 。
②甲酸分子中O-H键的类型是s-sp3σ键,C-H键的类型是_______ σ键,键角:α_______ β(填“>”“=”或“<”)。
(3)超强酸氟锑酸(结构如图)在化学和化学工业上有很大的应用价值,是活性极高的催化剂。

①该物质中∠FSbF为90°或180° ,则阴离子的空间构型为_______ 。
②阴离子的中心原子的杂化轨道类型是_______ (填序号)。
A. sp3d2 B. sp2 C. sp3 D. sp
(4)Mg2 NiH4是科学家研究的一种高效固态储氢材料。在Mg2NiH4晶胞中,Ni原子占据如图所示的顶点和面心,Mg2+处于图中八个小立方体的体心。Mg2+和Ni原子的最短距离为d nm,NA为阿伏加德罗常数的值,该晶体的密度为_______ g·cm-3(用含NA、d、M的代数式表示,Mg2NiH4的相对分子质量为M)。
(1)基态Co原子中,核外电子占据的最高能层的符号是
(2)铜锰氧化物( CuMn2O4)能在常温下催化氧化甲醛生成甲酸(结构如图)。

①甲酸的沸点比甲醛的
②甲酸分子中O-H键的类型是s-sp3σ键,C-H键的类型是
(3)超强酸氟锑酸(结构如图)在化学和化学工业上有很大的应用价值,是活性极高的催化剂。

①该物质中∠FSbF为90°或180° ,则阴离子的空间构型为
②阴离子的中心原子的杂化轨道类型是
A. sp3d2 B. sp2 C. sp3 D. sp
(4)Mg2 NiH4是科学家研究的一种高效固态储氢材料。在Mg2NiH4晶胞中,Ni原子占据如图所示的顶点和面心,Mg2+处于图中八个小立方体的体心。Mg2+和Ni原子的最短距离为d nm,NA为阿伏加德罗常数的值,该晶体的密度为

您最近一年使用:0次
2022-05-30更新
|
265次组卷
|
3卷引用:四川省仁寿第一中学校南校区2023-2024学年高三上学期11月期中考试理综化学试题
真题
名校
5 . 三磷酸腺苷(ATP) 和活性氧类(如 H2O2和O )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。
(1)ATP 的分子式为C10H16N5O13P3,其中电负性最大的元素是_______ ,基态 N原子的电子排布图为_______ 。
(2)H2O2 分子的氧原子的杂化轨道类型为:_______ ;H2O2和H2O能以任意比例互溶的原因是_______ 。
(3)O3分子的立体构型为_______ 。根据表中数据判断氧原子之间的共价键最稳定的粒子是_______ 。
(4)研究发现纳米CeO2可催化O 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。_______ nm。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0, ,
, ),则B离子的坐标为
),则B离子的坐标为_______ 。
③纳米CeO2中位于晶粒表面的Ce4+能发挥催化作用,在边长为2 a nm的立方体晶粒中位于表面的Ce4+最多有_______ 个。
 )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。(1)ATP 的分子式为C10H16N5O13P3,其中电负性最大的元素是
(2)H2O2 分子的氧原子的杂化轨道类型为:
(3)O3分子的立体构型为
| 粒子 | O2 | O | O3 |
| 键长/pm | 121 | 126 | 128 |
(4)研究发现纳米CeO2可催化O
 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。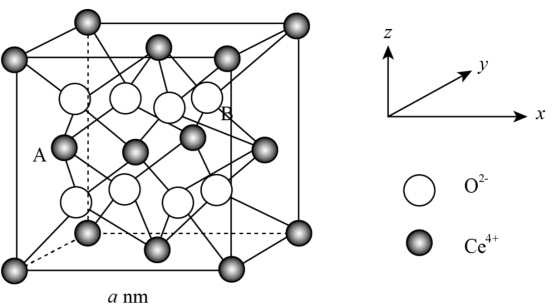
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0,
 ,
, ),则B离子的坐标为
),则B离子的坐标为③纳米CeO2中位于晶粒表面的Ce4+能发挥催化作用,在边长为2 a nm的立方体晶粒中位于表面的Ce4+最多有
您最近一年使用:0次
2022-05-27更新
|
4931次组卷
|
5卷引用:四川省内江市第六中学2022-2023学年高二下学期期中考试化学试题
四川省内江市第六中学2022-2023学年高二下学期期中考试化学试题(已下线)专题20 结构与性质(已下线)专题20 结构与性质宁夏回族自治区石嘴山市平罗中学2023-2024学年高三上学期第四次月考理科综合试题重庆市2021年高考真题化学试题
名校
解题方法
6 . 金属元素Mg、Al、Ti、Fe、Cu等在电池、储氢材料、催化剂等方面都有广泛应用。请回答下列问题:
(1)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是____ ,H、B、Ti的电负性由小到大的顺序为____ 。
(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用—
表示,与之相反的用— 表示,
表示,
 即称为电子的自旋磁量子数。对于基态Fe原子,其价电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态Fe原子,其价电子自旋磁量子数的代数和为____ 。
(3)Cu(NO3)2是有机催化剂,其水溶液为天蓝色。使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则Cu2+的杂化轨道类型为____ (填标号)。
A.dsp2 B.sp C.sp2 D.sp3
如图为一种Cu2+形成的配离子的结构,加热时该离子先失去的配位体是____ (填化学式),此时生成的配离子溶液的颜色为____ 色。

(4)已知Mg、A1、O三种元素组成的晶体结构如图所示,其晶胞由4个A型小晶格和4个B型小晶格构成,其中A13+和O2-都在小晶格内部,Mg2+部分在小晶格内部,部分在小晶格顶点。

该物质的化学式为____ ,Mg2+的配位数为____ ,两个Mg2+之间最近的距离是____ pm。
(1)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用—
表示,与之相反的用— 表示,
表示,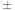
 即称为电子的自旋磁量子数。对于基态Fe原子,其价电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态Fe原子,其价电子自旋磁量子数的代数和为(3)Cu(NO3)2是有机催化剂,其水溶液为天蓝色。使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则Cu2+的杂化轨道类型为
A.dsp2 B.sp C.sp2 D.sp3
如图为一种Cu2+形成的配离子的结构,加热时该离子先失去的配位体是

(4)已知Mg、A1、O三种元素组成的晶体结构如图所示,其晶胞由4个A型小晶格和4个B型小晶格构成,其中A13+和O2-都在小晶格内部,Mg2+部分在小晶格内部,部分在小晶格顶点。

该物质的化学式为
您最近一年使用:0次
2022-05-24更新
|
805次组卷
|
4卷引用:四川省成都市第七中学2022-2023学年高二上学期期末质量检测化学试题
四川省成都市第七中学2022-2023学年高二上学期期末质量检测化学试题四川省成都市第七中学2022-2023学年高二上学期期末考试化学试卷山东省济宁市2022届高三下学期第三次模拟考试化学试题(已下线)2022年山东省高考真题变式题(非选择题)
名校
解题方法
7 . 高效节能、寿命长的半导体照明产品正在引领照明行业的绿色变革,而氮化镓(GaN)的研制是实现半导体照明的核心技术和基础,当前我国在第三代半导体材解研制方面走在世界的前列。回答下列有关问题。
(1)基态Ga原子的价层电子排布式为_______ 。
(2)GaN在加热条件下与NaOH溶液发生如下反应:CaN+OH-+H2O=GaO +NH3↑。
+NH3↑。
①基态N、O分别失去一个电子时,需要吸收能量更多的是_______ ,判断的理由是_______ 。
②GaO 在高氯酸的热溶液中可以生成化合物[Ga(H2O)6](ClO4)3,该化合物中提供孤电子对形成配位键的原子为
在高氯酸的热溶液中可以生成化合物[Ga(H2O)6](ClO4)3,该化合物中提供孤电子对形成配位键的原子为_______ ,1mol[Ga(H2O)6]3+中所含有的σ键数目为_______ , 与H2O相比,键角
与H2O相比,键角
_______ H2O(填“>”或“<”)。
(3)GaN的一种晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。
①氮化镓中镓原子的杂化方式为_______ ,与同一个Ga原子相连的N原子构成的空间构型为_______ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如下图所示,则2、3、4原子的分数坐标不可能的是_______ (填序号)。

a.(0.75,0.75,0.25) b.(0.75,0.25,0.75)
c.(0.25,0.25,0.25) d.(0.25,0.75,025)
③GaN晶体中N和N的原子核间距为apm,GaN的摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则GaN晶体的密度为_______ g·cm-3。
(1)基态Ga原子的价层电子排布式为
(2)GaN在加热条件下与NaOH溶液发生如下反应:CaN+OH-+H2O=GaO
 +NH3↑。
+NH3↑。①基态N、O分别失去一个电子时,需要吸收能量更多的是
②GaO
 在高氯酸的热溶液中可以生成化合物[Ga(H2O)6](ClO4)3,该化合物中提供孤电子对形成配位键的原子为
在高氯酸的热溶液中可以生成化合物[Ga(H2O)6](ClO4)3,该化合物中提供孤电子对形成配位键的原子为 与H2O相比,键角
与H2O相比,键角
(3)GaN的一种晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。
①氮化镓中镓原子的杂化方式为
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如下图所示,则2、3、4原子的分数坐标不可能的是

a.(0.75,0.75,0.25) b.(0.75,0.25,0.75)
c.(0.25,0.25,0.25) d.(0.25,0.75,025)
③GaN晶体中N和N的原子核间距为apm,GaN的摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则GaN晶体的密度为
您最近一年使用:0次
2022-04-19更新
|
520次组卷
|
2卷引用:四川省绵阳市南山中学实验学校2022-2023学年高二下学期3月月考化学试题



