解题方法
1 . I.完成下列问题。
(1)下列描述中正确的是_________
A.CO2为V形的极性分子
B. 的空间构型为平面四边形
的空间构型为平面四边形
C.PF5中有5对完全相同的成键电子对
D.SiF4和SO3的中心原子均为sp3杂化
II.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(2)Ni原子的价电子核外电子排布式为___________ 。
(3)FeO、NiO的晶体结构类型均与氯化钠的相同,Fe2+和Ni2+的离子半径分别为78pm和69pm,则熔点FeO___________ NiO (填“<”或“>”);
(4)Ni和O的配位数分别为_________ 、_________ ;若NiO晶胞中参数为apm,则NiO密度为___________ (列出计算表达式)。
(5)丁二酮肟常用于检验Ni2+,在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示:

①该结构中,碳原子的杂化轨道类型有___________ 。
②该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是___________ 。
③该结构中,氧氢之间除共价键外还可存在_________ 。
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,该合金的化学式为___________ 。

(1)下列描述中正确的是
A.CO2为V形的极性分子
B.
 的空间构型为平面四边形
的空间构型为平面四边形C.PF5中有5对完全相同的成键电子对
D.SiF4和SO3的中心原子均为sp3杂化
II.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(2)Ni原子的价电子核外电子排布式为
(3)FeO、NiO的晶体结构类型均与氯化钠的相同,Fe2+和Ni2+的离子半径分别为78pm和69pm,则熔点FeO
(4)Ni和O的配位数分别为
(5)丁二酮肟常用于检验Ni2+,在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示:

①该结构中,碳原子的杂化轨道类型有
②该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是
③该结构中,氧氢之间除共价键外还可存在
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,该合金的化学式为

您最近一年使用:0次
解题方法
2 . 镍的合金及其配合物用途非常广泛。回答下列问题:
(1)基态Ni原子的价电子排布式为___________ , 最高能级电子云轮廓图为___________ 形。
(2)Ni与Ca均位于第四周期,最外层电子数也相同,但Ni的熔点和沸点均比Ca的高,这是因为___________ 。
(3)镍可形成Ni(NH3)4(NCS)2、Ni(NH3)4 (NO2)2、K2[NiF4]等多种配合物。
①配体NCS-中,三种元素的电负性最大的是___________ 。
②配体 的空间构型为
的空间构型为___________ 形,中心原子的杂化方式是___________ 。
③K2[NiF4 ]可由反应NiF2 + 2KHF2=K2[NiF4]+2HF制取,KHF2晶体中所含的化学键类型有___________ (填字母)。
A.离子键 B.σ键 C.π键 D.非极性键
(4)Ni2 MnGa晶体的立方晶胞结构如图a所示。

①已知Ni2MnGa的晶胞参数为0.5822nm,设NA为阿伏加德罗常数的数值,则Ni2MnGa晶体的密度为___________ (列出计算式)g· cm-3。
②Ni2MnGa晶体的晶胞结构还可以用图b表示,若●表示的是Mn,则 表示的是
表示的是___________ ,⊕表示的是___________ 。

(1)基态Ni原子的价电子排布式为
(2)Ni与Ca均位于第四周期,最外层电子数也相同,但Ni的熔点和沸点均比Ca的高,这是因为
(3)镍可形成Ni(NH3)4(NCS)2、Ni(NH3)4 (NO2)2、K2[NiF4]等多种配合物。
①配体NCS-中,三种元素的电负性最大的是
②配体
 的空间构型为
的空间构型为③K2[NiF4 ]可由反应NiF2 + 2KHF2=K2[NiF4]+2HF制取,KHF2晶体中所含的化学键类型有
A.离子键 B.σ键 C.π键 D.非极性键
(4)Ni2 MnGa晶体的立方晶胞结构如图a所示。

①已知Ni2MnGa的晶胞参数为0.5822nm,设NA为阿伏加德罗常数的数值,则Ni2MnGa晶体的密度为
②Ni2MnGa晶体的晶胞结构还可以用图b表示,若●表示的是Mn,则
 表示的是
表示的是
您最近一年使用:0次
名校
解题方法
3 . 磷、氮和硫的相关化合物在药物化学及农业化学领域应用广泛。回答下列问题:
(1) 分子空间结构为
分子空间结构为___________ , 与
与 反应生成
反应生成 ,
, 结构为
结构为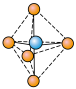 ,
, 是
是___________ (填“极性”或“非极性”)分子。
(2)氯吡苯脲是一种常用的膨大剂,其结构简式为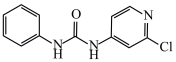 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。
①氯吡苯脲分子___________ (填“是”或“不是”)手性分子。
②氯吡苯脲分子中存在的作用力包括___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D. 键 E.配位键
键 E.配位键
(3)胆矾 可写成
可写成 ,其结构示意图如下:
,其结构示意图如下:
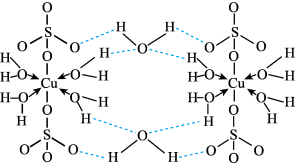
⑤该配合物的中心离子是___________ 。
②下列关于胆矾的说法正确的是___________ (填字母)。
A.基态 的价层电子排布式为
的价层电子排布式为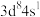
B.胆矾在不同温度下分步失去结晶水
C.根据结构图显示,胆矾在微观层次是平面结构
D.胆矾中的水分子间存在氢键
(1)
 分子空间结构为
分子空间结构为 与
与 反应生成
反应生成 ,
, 结构为
结构为 ,
, 是
是(2)氯吡苯脲是一种常用的膨大剂,其结构简式为
 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。①氯吡苯脲分子
②氯吡苯脲分子中存在的作用力包括
A.离子键 B.极性键 C.非极性键 D.
 键 E.配位键
键 E.配位键(3)胆矾
 可写成
可写成 ,其结构示意图如下:
,其结构示意图如下:
⑤该配合物的中心离子是
②下列关于胆矾的说法正确的是
A.基态
 的价层电子排布式为
的价层电子排布式为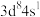
B.胆矾在不同温度下分步失去结晶水
C.根据结构图显示,胆矾在微观层次是平面结构
D.胆矾中的水分子间存在氢键
您最近一年使用:0次
2023-05-19更新
|
172次组卷
|
2卷引用:江西省赣州市第四中学2022-2023学年高二下学期6月期末化学试题
名校
解题方法
4 . 短周期主族元素X、Y、Z、G、T的原子序数依次增大,Z、G是金属元素且G的氧化物属于两性氧化物,T的原子序数是Y的2倍且T、Y的最低化合价相同。这5种元素的价电子数之和等于20,含Z元素的物质的焰色呈黄色。回答下列问题:
(1)X的最高价氧化物对应水化物的化学式为___________ 。位于元素周期表中s区的元素为___________ (填元素符号)。
(2)Y、Z、G、T的电负性由小到大的顺序为___________ (填元素符号)。
(3) 分子是
分子是___________ (填“极性”或“非极性”)分子。 分子中T的价层电子对数为
分子中T的价层电子对数为___________ 。
(4)Y和Z能形成既含离子键,又含共价键的化合物,其化学式为___________ 。
(5)V是由Y、Z、T组成的化合物,V的水溶液呈中性。则V的阴离子的空间构型___________ 。
(6)T的一种单质的结构如图所示: ,T原子杂化类型是
,T原子杂化类型是________ 。32gT的这种单质含σ键的数目为________ 。这种单质易溶于 ,不溶于水,其原因是
,不溶于水,其原因是_________ 。
(1)X的最高价氧化物对应水化物的化学式为
(2)Y、Z、G、T的电负性由小到大的顺序为
(3)
 分子是
分子是 分子中T的价层电子对数为
分子中T的价层电子对数为(4)Y和Z能形成既含离子键,又含共价键的化合物,其化学式为
(5)V是由Y、Z、T组成的化合物,V的水溶液呈中性。则V的阴离子的空间构型
(6)T的一种单质的结构如图所示:
 ,T原子杂化类型是
,T原子杂化类型是 ,不溶于水,其原因是
,不溶于水,其原因是
您最近一年使用:0次
2023-04-28更新
|
180次组卷
|
3卷引用:江西省南昌市等5地2022-2023学年高二下学期4月期中考试化学试题
解题方法
5 . I.回答下列问题:
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是_____________ 。
(2)基态As原子的价电子排布图为__________ ,基态Ga原子核外有____________ 个未成对电子。
(3)科学家合成了一种含硼阴离子[ ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为____ ,该结构中共有____________ 种不同化学环境的氧原子。

(4)四方晶系的CuFeS2晶胞结构如图所示:

①CuFeS2中各元素电负性数值从小到大的顺序为_______ ,晶胞中S原子的杂化方式为_________ 。
②晶胞中Cu和Fe的投影位置如图所示,设阿伏加德罗常数的值为NA,则该晶体的密度为____ g·cm-3。

(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是
(2)基态As原子的价电子排布图为
(3)科学家合成了一种含硼阴离子[
 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为
(4)四方晶系的CuFeS2晶胞结构如图所示:

①CuFeS2中各元素电负性数值从小到大的顺序为
②晶胞中Cu和Fe的投影位置如图所示,设阿伏加德罗常数的值为NA,则该晶体的密度为

您最近一年使用:0次
12-13高二上·四川遂宁·期中
名校
解题方法
6 . 下列说法错误的是
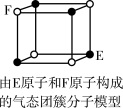
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近一年使用:0次
2022-10-31更新
|
245次组卷
|
8卷引用:江西省南昌市第十九中学2022-2023学年高二下学期3月第一次月考化学试卷
名校
解题方法
7 . “空气变馒头不是梦”,中国科学家在国际上首次实现了 到淀粉的从头合成,不依赖植物光合作用,原料只需
到淀粉的从头合成,不依赖植物光合作用,原料只需 、
、 和电,相关成果发表在《科学》上。请回答下列问题:
和电,相关成果发表在《科学》上。请回答下列问题:
(1) 的空间构型为
的空间构型为_______ ,其中C原子的杂化方式为_______ 。基态氧原子的最外层的成单电子和成对电子之比为_______ 。
(2)试推测
_______ (填“能”或“不能”)溶于 ,理由是
,理由是_______ 。
(3)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是_______ (用离子方程式表示)。
(4)淀粉在一定条件下可水解成葡萄糖( ),葡萄糖分子中键角
),葡萄糖分子中键角
_______ 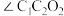 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(5)干冰的晶胞结构如下图所示,1个 分子周围与其距离相等且最近的
分子周围与其距离相等且最近的 分子个数为
分子个数为_______ 。若干冰晶胞沿x轴投影,试在图中画出 的投影位置(用“·”表示
的投影位置(用“·”表示 分子)。
分子)。_______
 到淀粉的从头合成,不依赖植物光合作用,原料只需
到淀粉的从头合成,不依赖植物光合作用,原料只需 、
、 和电,相关成果发表在《科学》上。请回答下列问题:
和电,相关成果发表在《科学》上。请回答下列问题:(1)
 的空间构型为
的空间构型为(2)试推测

 ,理由是
,理由是(3)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是
(4)淀粉在一定条件下可水解成葡萄糖(
 ),葡萄糖分子中键角
),葡萄糖分子中键角
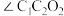 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(5)干冰的晶胞结构如下图所示,1个
 分子周围与其距离相等且最近的
分子周围与其距离相等且最近的 分子个数为
分子个数为 的投影位置(用“·”表示
的投影位置(用“·”表示 分子)。
分子)。
您最近一年使用:0次
2022-05-21更新
|
355次组卷
|
3卷引用:江西省南昌市第十九中学2022-2023学年高二下学期3月第一次月考化学试卷
江西省南昌市第十九中学2022-2023学年高二下学期3月第一次月考化学试卷 河北省唐山市2022届高三第三次模拟考试化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编
名校
解题方法
8 . 根据所学物质结构与性质的知识回答下列问题。
(1)超分子化学已逐渐扩展到化学的各个领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
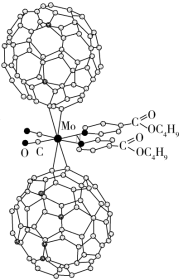
①Mo处于第五周期第VIB族,价电子排布与Cr相似,它的基态价电子排布图是___________ ,该超分子中存在的化学键类型有___________ (填选项字母)。
A.离子键B.氢键C.σ键D.π键
②该超分子中,配体CO提供孤电子对的原子是___________ (填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有___________ 。
(2)氟及其化合物用途非常广泛。
①聚四氟乙烯是一种准晶体,可通过___________ 方法区分晶体、准晶体和非晶体。
②AsF3、IF 、OF2,BeF2中价层电子对数不同于其它微粒的是
、OF2,BeF2中价层电子对数不同于其它微粒的是___________ (填化学式,下同),其立体构型为___________ 。
③室温氟穿梭电池的电解质为氟氢离子液体,含HF 、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式
、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式___________ 。
④基于CaF2设计的Born-Haber循环如图所示。
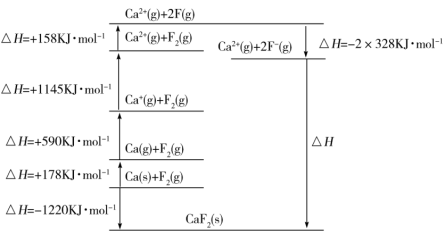
钙的第一电离能为___________ kJ·mol-1;F-F键的键能为___________ kJ·mol-1。
(1)超分子化学已逐渐扩展到化学的各个领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。

①Mo处于第五周期第VIB族,价电子排布与Cr相似,它的基态价电子排布图是
A.离子键B.氢键C.σ键D.π键
②该超分子中,配体CO提供孤电子对的原子是
(2)氟及其化合物用途非常广泛。
①聚四氟乙烯是一种准晶体,可通过
②AsF3、IF
 、OF2,BeF2中价层电子对数不同于其它微粒的是
、OF2,BeF2中价层电子对数不同于其它微粒的是③室温氟穿梭电池的电解质为氟氢离子液体,含HF
 、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式
、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式④基于CaF2设计的Born-Haber循环如图所示。

钙的第一电离能为
您最近一年使用:0次
2021-08-30更新
|
319次组卷
|
2卷引用:江西省抚州市资溪县第一中学2022-2023学年高二下学期5月期中考试化学试题



