名校
解题方法
1 . 我国将镓列为战略储备金属,我国的镓储量占世界储量的80%以上。请回答:
(1)基态镓原子最外层的电子排布图为________ ,最高能级的电子云形状为_________ 。
(2)镓可与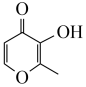 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga(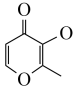 )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是___________ (填名称);每个甲基麦芽酚分子中含有___________ 个σ键。
(3)镓的卤化物熔点如表所示:
①氯化镓中镓的杂化方式与下列微粒的中心原子的杂化方式相同且氯化镓的空间结构也与其微粒相同的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
②各物质的熔点从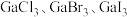 到
到 依次升高,原因是
依次升高,原因是___________ 。
(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以___________ 键结合。
(1)基态镓原子最外层的电子排布图为
(2)镓可与
 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga( )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是(3)镓的卤化物熔点如表所示:
| 物质 |  |  |  |  |
| 熔点/℃ | 1000 | 78 | 124 | 213 |
A.
 B.
B. C.
C. D.
D.
②各物质的熔点从
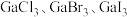 到
到 依次升高,原因是
依次升高,原因是(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以
您最近一年使用:0次
名校
解题方法
2 . 二茂铁(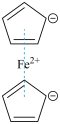 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
(1)Fe在周期表中的___________ 区,Fe变为Fe2+时是失去___________ 轨道电子;若受热后Fe的1个4s电子会跃迁至4p轨道,写出Fe的该激发态电子排布式:[Ar]___________ 。
(2)羰基铁粉【Fe(CO)5】中铁元素的配位数是___________ ,配位原子为___________ 。
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为___________ ;H3O+中氧原子的杂化方式为___________ ,H3O+空间构型为___________ 。
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每 个碳原子被一个由四个碳原子组成的正四面体结构单元( )所取代(如图乙)。
)所取代(如图乙)。

一个T-碳晶胞中含有___________ 个碳原子,已知T-碳的密度约为金刚石的一半。则T-碳晶胞的边长和金刚石晶胞的边长之比为___________ 。
 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。(1)Fe在周期表中的
(2)羰基铁粉【Fe(CO)5】中铁元素的配位数是
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每 个碳原子被一个由四个碳原子组成的正四面体结构单元(
 )所取代(如图乙)。
)所取代(如图乙)。
一个T-碳晶胞中含有
您最近一年使用:0次
名校
解题方法
3 .  具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用一直是科学研究的重要课题。
的合成及应用一直是科学研究的重要课题。
(1)以 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。
①基态Fe原子的电子排布式为___________ 。
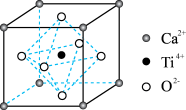
②实际生产中采用铁的氧化物 、
、 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
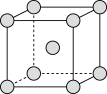
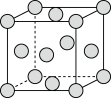
ⅰ.两种晶胞所含铁原子个数比为___________ 。
ⅱ.图1晶胞的棱长为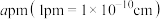 ,则其密度
,则其密度
___________  。
。
③我国科学家开发出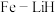 等双中心催化剂,在合成
等双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能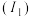 :
: ,从原子结构角度解释原因
,从原子结构角度解释原因___________ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
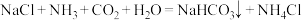
①1体积水可溶解1体积 ,1体积水可溶解约700体积
,1体积水可溶解约700体积 。
。 极易溶于水的原因是
极易溶于水的原因是___________ 。
②反应时,向饱和 溶液中先通入
溶液中先通入___________ 。
③ 分解得
分解得 。
。 空间结构为
空间结构为___________ 。
(3) 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
① 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为___________ 。
② 存在配位键,写出其体现配位键的结构式
存在配位键,写出其体现配位键的结构式___________ 。
③比较熔点:
___________  (填“>”或“<”)。
(填“>”或“<”)。
 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用一直是科学研究的重要课题。
的合成及应用一直是科学研究的重要课题。
(1)以
 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。①基态Fe原子的电子排布式为
②实际生产中采用铁的氧化物
 、
、 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:

ⅰ.两种晶胞所含铁原子个数比为
ⅱ.图1晶胞的棱长为
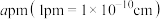 ,则其密度
,则其密度
 。
。③我国科学家开发出
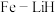 等双中心催化剂,在合成
等双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能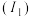 :
: ,从原子结构角度解释原因
,从原子结构角度解释原因(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
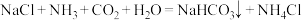
①1体积水可溶解1体积
 ,1体积水可溶解约700体积
,1体积水可溶解约700体积 。
。 极易溶于水的原因是
极易溶于水的原因是②反应时,向饱和
 溶液中先通入
溶液中先通入③
 分解得
分解得 。
。 空间结构为
空间结构为(3)
 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。| 元素 | H | B | N |
| 电负性 | 2.1 | 2.0 | 3.0 |
 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为②
 存在配位键,写出其体现配位键的结构式
存在配位键,写出其体现配位键的结构式③比较熔点:

 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
名校
解题方法
4 . 锗(Ge)、碲化镉(CdTe)等是优良的半导体材料。回答下列问题:
(1)Ge在元素周期表中的位置___________ ,Ge的逐级电离能I4≪I5的原因是___________ 。
(2)经X射线衍射实验证明在碲酸( )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为___________ 。
(3)锗可以形成无机化合物 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为___________ ,锗也可以形成类似于烷烃结构的 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为___________ , 该分子中含有的
该分子中含有的 键数目为
键数目为___________ 。
(4)锗的氯化物 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是___________ , 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有___________ 个。
(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为___________ 空隙(填几何构型名称),若CdTe的摩尔质量为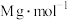 ,该晶体的密度为
,该晶体的密度为 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离___________ nm。(用含M、 、
、 的代数式表示)
的代数式表示)

(1)Ge在元素周期表中的位置
(2)经X射线衍射实验证明在碲酸(
 )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为(3)锗可以形成无机化合物
 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为 该分子中含有的
该分子中含有的 键数目为
键数目为(4)锗的氯化物
 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为
 ,该晶体的密度为
,该晶体的密度为 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题:
(1)尿素( )中碳原子杂化轨道类型是
)中碳原子杂化轨道类型是_______ 。NH 离子的VSEPR模型是
离子的VSEPR模型是_______ ,空间构型是_______ 。
(2)Ti3+能形成配合物[TiCl(H2O)5]Cl2·H2O,其中内界是_______ ,配位数为_______ 。在0.5mol该配合物溶液中滴加足量的AgNO3溶液,产生沉淀的物质的量是_______ 。
(3)肼(N2H4)可用作火箭燃料等,它的沸点远高于乙烯的原因是_______ 。
(4)硒化锌的晶胞结构如图所示,硒化锌的化学式为_______ 。

(5)Cu2O和Cu2S都是离子晶体,熔点较高的是_______ ,原因是_______ 。
(1)尿素(
 )中碳原子杂化轨道类型是
)中碳原子杂化轨道类型是 离子的VSEPR模型是
离子的VSEPR模型是(2)Ti3+能形成配合物[TiCl(H2O)5]Cl2·H2O,其中内界是
(3)肼(N2H4)可用作火箭燃料等,它的沸点远高于乙烯的原因是
(4)硒化锌的晶胞结构如图所示,硒化锌的化学式为

(5)Cu2O和Cu2S都是离子晶体,熔点较高的是
您最近一年使用:0次
名校
解题方法
6 . 磷酸亚铁锂( )电池是目前主流的动力电池之一,安全性较好。文献报道可采用
)电池是目前主流的动力电池之一,安全性较好。文献报道可采用 、
、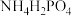 、LiCl和苯胺等作为原料制备磷酸亚铁锂。请回答下列问题:
、LiCl和苯胺等作为原料制备磷酸亚铁锂。请回答下列问题:
(1)基态Fe的价层电子轨道表示式为_____ 。
(2)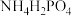 和
和 属于简单磷酸盐,
属于简单磷酸盐,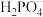 的结构如下图所示,则P原子杂化轨道类型是
的结构如下图所示,则P原子杂化轨道类型是_____ ,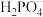 的空间构型为
的空间构型为_____ 。 )的晶体类型是
)的晶体类型是_____ 。
(4)一些氧化物的熔点如下表所示:
解释表中氧化物之间熔点差异的原因_____ 。
(5)某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:_____ 个。
②已知该晶胞的边长为anm,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为_____  。(
。( )
)
 )电池是目前主流的动力电池之一,安全性较好。文献报道可采用
)电池是目前主流的动力电池之一,安全性较好。文献报道可采用 、
、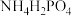 、LiCl和苯胺等作为原料制备磷酸亚铁锂。请回答下列问题:
、LiCl和苯胺等作为原料制备磷酸亚铁锂。请回答下列问题:(1)基态Fe的价层电子轨道表示式为
(2)
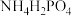 和
和 属于简单磷酸盐,
属于简单磷酸盐,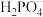 的结构如下图所示,则P原子杂化轨道类型是
的结构如下图所示,则P原子杂化轨道类型是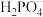 的空间构型为
的空间构型为
 )的晶体类型是
)的晶体类型是(4)一些氧化物的熔点如下表所示:
| 氧化物 |  |  |  |
| 熔点/℃ | 1723 | 23.8 | -75.5 |
(5)某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:

②已知该晶胞的边长为anm,阿伏加德罗常数为
 ,该晶体的密度为
,该晶体的密度为 。(
。( )
)
您最近一年使用:0次
名校
7 . 镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为___________ 。
(2)LiGaH4是一种温和的还原剂,其可由GaCl3和过量的LiH反应制得: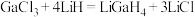 。
。
①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为___________ 。
② 的立体构型为
的立体构型为___________ 。
(3)一种含镓的药物合成方法如图所示:
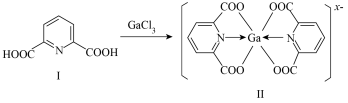
化合物Ⅰ中环上C原子的杂化方式为________ ,1mol化合物Ⅰ中含有的 键的物质的量为
键的物质的量为___________ 。
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:
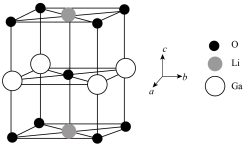
①上述晶胞沿着a轴的投影图为________ (填选项字母)。
A.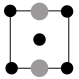 B.
B.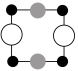 C.
C.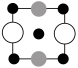
②用 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为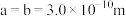 ,
,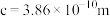 ,则其密度为
,则其密度为________  (列出计算式即可)。
(列出计算式即可)。
(1)基态Ga原子的价层电子排布式为
(2)LiGaH4是一种温和的还原剂,其可由GaCl3和过量的LiH反应制得:
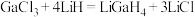 。
。①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
②
 的立体构型为
的立体构型为(3)一种含镓的药物合成方法如图所示:

化合物Ⅰ中环上C原子的杂化方式为
 键的物质的量为
键的物质的量为(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B. C.
C.
②用
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为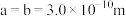 ,
,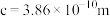 ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2023-06-30更新
|
93次组卷
|
2卷引用:广东省珠海市斗门第一中学2022-2023学年高二下学期6月月考化学试题
名校
解题方法
8 . 氯吡苯脲是一种常用的膨大剂,其结构简式如图,它是经国家批准使用的植物生长调节剂。
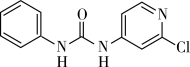
(1)氯元素基态原子核外电子的未成对电子数为_______ 。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为_______ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如图:

反应过程中,每生成1mol氯吡苯脲,断裂_______ 个 键,断裂
键,断裂_______ 个 键。
键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为_______
②NH3分子的空间结构是_______ ,H2O中心原子的杂化类型是_______

(1)氯元素基态原子核外电子的未成对电子数为
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如图:

反应过程中,每生成1mol氯吡苯脲,断裂
 键,断裂
键,断裂 键。
键。(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为
②NH3分子的空间结构是
您最近一年使用:0次
解题方法
9 . 我国某科研工作者制备了一种高性能的钾离子电池负极材料(Bi-MOF),如图所示。回答下列问题:

(1)铋的原子序数为83,则基态铋原子的外围电子排布图为_______ ,能量最高的电子所占据的原子轨道的电子云轮廓图为_______ 形。
(2)Bi(NO3)3·5H2O中H2O的VSEPR模型为_______ 形; 的立体构型为
的立体构型为_______ 形,H2O的键角_______ (填“>”、“<”或“=”) 的键角。
的键角。
(3)C、N、O的第一电离能由小到大的顺序为_______ ;BTC中C原子的杂化类型有_______ 。
(4)该电池负极材料充电时,会形成钾铋合金(化学式为K3Bi),其晶胞结构如图,晶胞参数为anm、bnm、cnm,以晶胞参数为单位长度建立原子分数坐标,表示晶胞中的原子位置,若1号原子的坐标为(0,0, ),3号原子的坐标为(1,0,
),3号原子的坐标为(1,0, )。
)。

①2号原子的坐标为_______ 。
②设NA为阿伏加德罗常数的值,该晶体的密度为_______ g·cm-3。

(1)铋的原子序数为83,则基态铋原子的外围电子排布图为
(2)Bi(NO3)3·5H2O中H2O的VSEPR模型为
 的立体构型为
的立体构型为 的键角。
的键角。(3)C、N、O的第一电离能由小到大的顺序为
(4)该电池负极材料充电时,会形成钾铋合金(化学式为K3Bi),其晶胞结构如图,晶胞参数为anm、bnm、cnm,以晶胞参数为单位长度建立原子分数坐标,表示晶胞中的原子位置,若1号原子的坐标为(0,0,
 ),3号原子的坐标为(1,0,
),3号原子的坐标为(1,0, )。
)。
①2号原子的坐标为
②设NA为阿伏加德罗常数的值,该晶体的密度为
您最近一年使用:0次
2023-05-26更新
|
113次组卷
|
3卷引用:河南省驻马店市2022-2023学年高二下学期5月月考化学试题
名校
解题方法
10 . 磷、氮和硫的相关化合物在药物化学及农业化学领域应用广泛。回答下列问题:
(1) 分子空间结构为
分子空间结构为___________ , 与
与 反应生成
反应生成 ,
, 结构为
结构为 ,
, 是
是___________ (填“极性”或“非极性”)分子。
(2)氯吡苯脲是一种常用的膨大剂,其结构简式为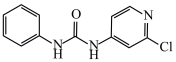 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。
①氯吡苯脲分子___________ (填“是”或“不是”)手性分子。
②氯吡苯脲分子中存在的作用力包括___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D. 键 E.配位键
键 E.配位键
(3)胆矾 可写成
可写成 ,其结构示意图如下:
,其结构示意图如下:
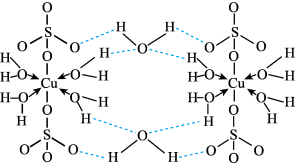
⑤该配合物的中心离子是___________ 。
②下列关于胆矾的说法正确的是___________ (填字母)。
A.基态 的价层电子排布式为
的价层电子排布式为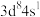
B.胆矾在不同温度下分步失去结晶水
C.根据结构图显示,胆矾在微观层次是平面结构
D.胆矾中的水分子间存在氢键
(1)
 分子空间结构为
分子空间结构为 与
与 反应生成
反应生成 ,
, 结构为
结构为 ,
, 是
是(2)氯吡苯脲是一种常用的膨大剂,其结构简式为
 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。①氯吡苯脲分子
②氯吡苯脲分子中存在的作用力包括
A.离子键 B.极性键 C.非极性键 D.
 键 E.配位键
键 E.配位键(3)胆矾
 可写成
可写成 ,其结构示意图如下:
,其结构示意图如下:
⑤该配合物的中心离子是
②下列关于胆矾的说法正确的是
A.基态
 的价层电子排布式为
的价层电子排布式为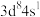
B.胆矾在不同温度下分步失去结晶水
C.根据结构图显示,胆矾在微观层次是平面结构
D.胆矾中的水分子间存在氢键
您最近一年使用:0次
2023-05-19更新
|
172次组卷
|
2卷引用:山西省运城市教育联盟2022-2023学年高二下学期5月月考化学试题



