解题方法
1 . 下列说法正确的是
A. 分子的极性比 分子的极性比 的大 的大 |
B.无机含氧酸的酸性: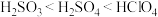 |
C. 的分子构型为 的分子构型为 形,则二甲醚的分子骨架 形,则二甲醚的分子骨架 构型为 构型为 形 形 |
D.键角: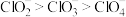 |
您最近半年使用:0次
名校
解题方法
2 . 氮的相关化合物在材料等方面有重要用途。回答下列问题:
(1)在第二周期中,第一电离能比N高的主族元素是_______ 。氮原子的电子排布图表示的状态中,能量由低到高的顺序是_______ (填序号)。
A. B.
B.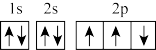
C.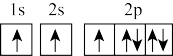 D.
D.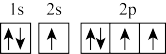
(2)科学家从(NH4)2SO4中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO 和N4H
和N4H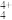 两种离子的形式存在。N4H
两种离子的形式存在。N4H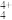 的空间构型与NH
的空间构型与NH 相同,则1个N4H
相同,则1个N4H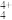 中含有
中含有_______ 个σ键。
(3)科学家合成了一种阳离子为“N ”,其结构是对称的,5个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N
”,其结构是对称的,5个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N ”化学式为N8的离子晶体,其阳离子电子式为
”化学式为N8的离子晶体,其阳离子电子式为_______ ,阴离子的空间构型为_______ 。
(4)GaN、GaP、GaAs熔融状态均不导电,熔点如表所示。其中GaN晶胞如图所示,结构可看作金刚石晶胞内部的碳原子被N原子代替(如b),顶点和面心的碳原子被Ga原子代替(如a)。

①试分析GaN、GaP、GaAs熔点依次降低的原因:_______ ;
②GaN晶胞中与Ga原子周围与它最近且相等距离的Ga原子有_______ 个。
(1)在第二周期中,第一电离能比N高的主族元素是
A.
 B.
B.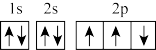
C.
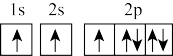 D.
D.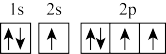
(2)科学家从(NH4)2SO4中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO
 和N4H
和N4H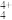 两种离子的形式存在。N4H
两种离子的形式存在。N4H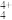 的空间构型与NH
的空间构型与NH 相同,则1个N4H
相同,则1个N4H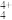 中含有
中含有(3)科学家合成了一种阳离子为“N
 ”,其结构是对称的,5个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N
”,其结构是对称的,5个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N ”化学式为N8的离子晶体,其阳离子电子式为
”化学式为N8的离子晶体,其阳离子电子式为(4)GaN、GaP、GaAs熔融状态均不导电,熔点如表所示。其中GaN晶胞如图所示,结构可看作金刚石晶胞内部的碳原子被N原子代替(如b),顶点和面心的碳原子被Ga原子代替(如a)。

| 物质 | GaN | GaP | GaAs |
| 熔点/℃ | 1700 | 1480 | 1238 |
②GaN晶胞中与Ga原子周围与它最近且相等距离的Ga原子有
您最近半年使用:0次
2022-12-22更新
|
534次组卷
|
3卷引用:浙江省金华第一中学等四校2022-2023学年高三上学期12月联考化学试题
名校
解题方法
3 . 科学家合成了一种新化合物(如图所示),其中X、Y是第三周期的非金属元素,各原子均满足8电子稳定结构。

(1)硅原子最外电子层有_____ 种运动状态不同的电子。
(2)由题意可推知Y是Cl,推得此结论的依据是_____ 。X和Si之间共用电子对偏向_____ 。
(3)SiCl4分子空间构型是_____ 。请说明SiCl4和CCl4沸点高低的理由:_____ 。
(4)硅提纯工艺中的尾气CO可用于生产草酸氢钾(KHC2O4)或草酸钾(K2C2O4)。已知草酸氢钾溶液呈酸性,草酸钾溶液呈碱性。
①草酸氢钾溶液中,c(H2C2O4)______ c( )。(选填:“>”、“<”或“=”)
)。(选填:“>”、“<”或“=”)
②向草酸氢钾溶液里滴加NaOH溶液,反应的离子方程式为_____ 。当滴加至中性时,c(K+)_____ c(Na+)。(选填:“>”、“<”或“=”)
(5)白磷(P4)分子的键角是_____ ,白磷与过量浓NaOH溶液反应,产生PH3和次磷酸钠。
①补全并配平该反应的化学方程式_____ 。
____P4+____NaOH+________→____PH3↑+____NaH2PO2
②标出电子转移的数目和方向:_____ 。
③其中氧化剂和还原剂物质的量之比为______ 。

(1)硅原子最外电子层有
(2)由题意可推知Y是Cl,推得此结论的依据是
(3)SiCl4分子空间构型是
(4)硅提纯工艺中的尾气CO可用于生产草酸氢钾(KHC2O4)或草酸钾(K2C2O4)。已知草酸氢钾溶液呈酸性,草酸钾溶液呈碱性。
①草酸氢钾溶液中,c(H2C2O4)
 )。(选填:“>”、“<”或“=”)
)。(选填:“>”、“<”或“=”)②向草酸氢钾溶液里滴加NaOH溶液,反应的离子方程式为
(5)白磷(P4)分子的键角是
①补全并配平该反应的化学方程式
____P4+____NaOH+________→____PH3↑+____NaH2PO2
②标出电子转移的数目和方向:
③其中氧化剂和还原剂物质的量之比为
您最近半年使用:0次
解题方法
4 . 回答下列问题
(1)选择题(题目给出的四个选项中,有两个 选项是符合题目要求的)下列关于晶体的说法中,不正确 的是_____
(2)黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:2CuFeS2 + O2 = Cu2S + 2FeS + SO2。
①Fe在周期表中的位置为_______ ;Fe、S、O原子的第一电离能由大到小的顺序是_______ 。
②Cu元素的基态原子的电子排布式为_______ ,有_______ 个未成对电子。
③SO2分子的立体构型为_______ ,SO2可氧化生成SO3,SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______ 。

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因_______ 。
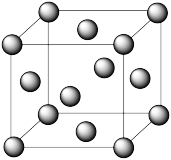
⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有_______ 个,晶胞的边长为_______ (用含ρ和NA的式子表示)。
(1)选择题(题目给出的四个选项中,有
| A.MgO的晶格能远比NaCl大,这是因为前者粒子所带的电荷多,粒子半径小 |
| B.第一电离能:Cl>S>P>Si |
| C.金属原子在二维平面里放置得到非密置层和密置层两种方式,配位数分别为4和6 |
| D.共价键可决定分子晶体的熔、沸点 |
①Fe在周期表中的位置为
②Cu元素的基态原子的电子排布式为
③SO2分子的立体构型为

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因

⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有
您最近半年使用:0次
解题方法
5 . 三价铬离子(Cr3+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
(1)Cr的价电子排布式为_______ 。
(2)O、N、S的原子半径由大到小的顺序为_______ 。
(3)SO2分子的 VSEPR模型名称为_______
(4)化学式为CrCl3·6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl·2H2O,该物质的配离子中提供孤电子对的原子为_______ ,配位数为_______ 。
(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg/cm3,则该晶胞的棱长为_______ cm。
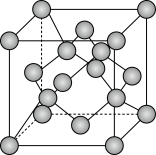
(1)Cr的价电子排布式为
(2)O、N、S的原子半径由大到小的顺序为
(3)SO2分子的 VSEPR模型名称为
(4)化学式为CrCl3·6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl·2H2O,该物质的配离子中提供孤电子对的原子为
(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg/cm3,则该晶胞的棱长为

您最近半年使用:0次
解题方法
6 . 五氧化二钒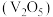 和三氧化钼
和三氧化钼 是两种重要的过渡金属氧化物,通常用作工业催化剂。有企业通过废旧催化剂(主要成分为
是两种重要的过渡金属氧化物,通常用作工业催化剂。有企业通过废旧催化剂(主要成分为 、
、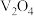 、
、 ,还有少量的
,还有少量的 、
、 、有机物等)来制备这两种氧化物。工艺流程图如下图:
、有机物等)来制备这两种氧化物。工艺流程图如下图:
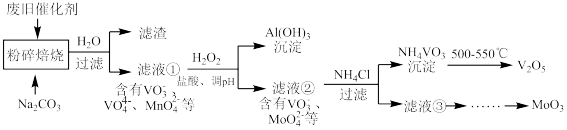
(1)“焙烧”的目的是_______ 。
(2)滤渣的主要成分是_______ (填化学式)。
(3)向滤液①中加 的作用是
的作用是_______ (用离子方程式表示)。
(4)当滤液①pH调控为8时,写出计算过程说明此时铝元素是否沉淀完全_______ 。(已知:
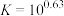 ,离子浓度小于
,离子浓度小于 认为沉淀完全)
认为沉淀完全)
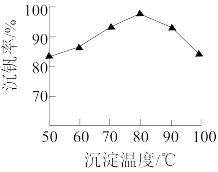
(5) 的沉淀过程中,沉钒率受温度影响,关系如图所示。温度高于80℃沉钒率降低的主要原因是
的沉淀过程中,沉钒率受温度影响,关系如图所示。温度高于80℃沉钒率降低的主要原因是_______ 。 的沉淀分解生成
的沉淀分解生成 的化学方程式是
的化学方程式是_______ 。
(6)仪器分析检测 在水中带有结晶水
在水中带有结晶水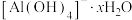 ,
, 与结晶水之间的作用力是_______(填字母)。
与结晶水之间的作用力是_______(填字母)。
(7)Mo原子序数42,气相单分子 空间结构是
空间结构是_______ 。
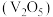 和三氧化钼
和三氧化钼 是两种重要的过渡金属氧化物,通常用作工业催化剂。有企业通过废旧催化剂(主要成分为
是两种重要的过渡金属氧化物,通常用作工业催化剂。有企业通过废旧催化剂(主要成分为 、
、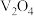 、
、 ,还有少量的
,还有少量的 、
、 、有机物等)来制备这两种氧化物。工艺流程图如下图:
、有机物等)来制备这两种氧化物。工艺流程图如下图:
(1)“焙烧”的目的是
(2)滤渣的主要成分是
(3)向滤液①中加
 的作用是
的作用是(4)当滤液①pH调控为8时,写出计算过程说明此时铝元素是否沉淀完全

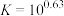 ,离子浓度小于
,离子浓度小于 认为沉淀完全)
认为沉淀完全)(5)
 的沉淀过程中,沉钒率受温度影响,关系如图所示。温度高于80℃沉钒率降低的主要原因是
的沉淀过程中,沉钒率受温度影响,关系如图所示。温度高于80℃沉钒率降低的主要原因是 的沉淀分解生成
的沉淀分解生成 的化学方程式是
的化学方程式是
(6)仪器分析检测
 在水中带有结晶水
在水中带有结晶水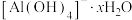 ,
, 与结晶水之间的作用力是_______(填字母)。
与结晶水之间的作用力是_______(填字母)。| A.离子键 | B.配位键 | C.氢键 | D.范德华力 |
 空间结构是
空间结构是
您最近半年使用:0次
名校
解题方法
7 . 科学家发现固体电解质Li3SBF4快离子导体具有良好的导电能力,为锂离子电池的发展做出了重要贡献。回答下列问题:
(1)基态F原子的价电子排布图为_______ 。B和F均为第2周期元素,在第2周期元素中,第一电离能介于B与F之间的元素有_______ 种。
(2)一种硼酸盐的阴离子为B3O4n-,其结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O 的结构图
的结构图_______ (注明所带电荷数)。[B5O6(OH)4]-的结构为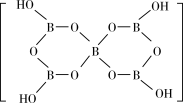 ,则B原子的配位数是
,则B原子的配位数是_______ 。
(3)L3SBF4可由Li2S与LiBF4按一定比例反应合成。Li2S和LiBF4的熔点如表所示:
Li2S与LiBF4均属于_______ 晶体;熔点:Li2S>LiBF4,原因是_______ 。
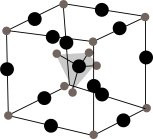
(4)Li3SBF4的晶胞结构如图所示,其中BF 位于体心,则Li+位于
位于体心,则Li+位于_______ (填“顶点”或“棱边”)。设NA为阿伏加德罗常数的值,若该晶胞中Li+与BF 间的最近距离为apm,则晶体密度为
间的最近距离为apm,则晶体密度为_______ g·cm-3,在Li3SBF4晶胞的另一种结构中,BF 位于顶点,则S2-位于
位于顶点,则S2-位于_______ (填“体心”“面心”或“棱边”)。
(1)基态F原子的价电子排布图为
(2)一种硼酸盐的阴离子为B3O4n-,其结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O
 的结构图
的结构图 ,则B原子的配位数是
,则B原子的配位数是(3)L3SBF4可由Li2S与LiBF4按一定比例反应合成。Li2S和LiBF4的熔点如表所示:
| 物质 | Li2S | LiBF4 |
| 熔点/℃ | 938 | 300 |
(4)Li3SBF4的晶胞结构如图所示,其中BF
 位于体心,则Li+位于
位于体心,则Li+位于 间的最近距离为apm,则晶体密度为
间的最近距离为apm,则晶体密度为 位于顶点,则S2-位于
位于顶点,则S2-位于
您最近半年使用:0次
12-13高二上·四川遂宁·期中
名校
解题方法
8 . 下列说法错误的是
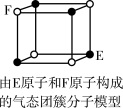
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近半年使用:0次
2022-10-31更新
|
243次组卷
|
8卷引用:2012-2013学年四川省遂宁二中高二上学期期中考试化学试卷
真题
解题方法
9 . 含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为_____ 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是____ ,原因是_____ 。
(3)SnCl 的几何构型为
的几何构型为____ ,其中心离子杂化方式为____ 。
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是____ (填标号)。
(5)如图是硫的四种含氧酸根的结构:
A. B.
B. 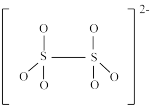 C.
C.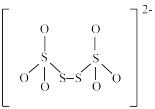 D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO 的是
的是____ (填标号),理由是____ 。
(6)如图是CZTS四元半导体化合物的四方晶胞。
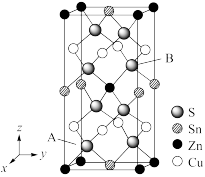
①该物质的化学式为_____ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( ,
, ,
, ),则B原子的坐标为
),则B原子的坐标为_____ 。
(1)基态S原子的价电子中,两种自旋状态的电子数之比为
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是
(3)SnCl
 的几何构型为
的几何构型为(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是
| A.[Cu(NH3)2]Cl | B.[Cu(NH3)4]SO4 | C.[Zn(NH3)4]SO4 | D.Na2[Zn(OH)4] |
A.
 B.
B.  C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO
 的是
的是(6)如图是CZTS四元半导体化合物的四方晶胞。

①该物质的化学式为
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为(
 ,
, ,
, ),则B原子的坐标为
),则B原子的坐标为
您最近半年使用:0次
解题方法
10 . 锰、铬、钴、铁的单质及其化合物在科研和生产中有着重要用途。回答下列问题:
(1)基态锰原子的价电子排布式为_______ 。
(2) 和
和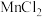 均为离子化合物,
均为离子化合物, 的熔点高于
的熔点高于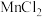 熔点的原因为
熔点的原因为_______ 。
(3)化学式为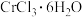 的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,
的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中, 的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量
的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量 溶液,所得
溶液,所得 沉淀的物质的量之比为3∶2∶1。
沉淀的物质的量之比为3∶2∶1。
①呈暗绿色的配合物,其内界的离子符号为_______ 。
② 分子的
分子的 模型为
模型为_______ 。
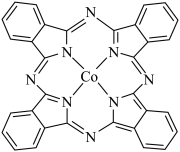
(4)如图为酞菁钴分子的平面结构,下列说法正确的是_______(填标号)。
(5)如图是一种由Y(与 同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
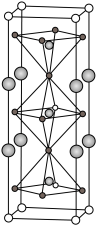
①该晶体的化学式为_______ 。
②其中Y的配位数为_______ 。
③在氧气气氛中该晶体可被部分氧化,氧原子进入晶格而使晶体呈现深紫色。新进入的氧原子在晶胞中的位置是_______ 。
(1)基态锰原子的价电子排布式为
(2)
 和
和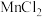 均为离子化合物,
均为离子化合物, 的熔点高于
的熔点高于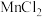 熔点的原因为
熔点的原因为(3)化学式为
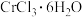 的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,
的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中, 的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量
的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量 溶液,所得
溶液,所得 沉淀的物质的量之比为3∶2∶1。
沉淀的物质的量之比为3∶2∶1。①呈暗绿色的配合物,其内界的离子符号为
②
 分子的
分子的 模型为
模型为(4)如图为酞菁钴分子的平面结构,下列说法正确的是_______(填标号)。

A.电负性: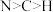 | B.4个N原子均与 形成配位键 形成配位键 |
C.分子中N的杂化轨道类型均为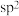 | D.第一电离能: |
 同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
①该晶体的化学式为
②其中Y的配位数为
③在氧气气氛中该晶体可被部分氧化,氧原子进入晶格而使晶体呈现深紫色。新进入的氧原子在晶胞中的位置是
您最近半年使用:0次



