名校
解题方法
1 . 氮、磷、砷 、锑
、锑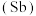 、铋
、铋 、镆
、镆 为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1) 中
中 键和
键和 键的数目比例是
键的数目比例是___________ ,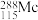 的中子数为
的中子数为___________ 。
(2)①已知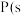 ,白磷)
,白磷) ,黑磷),该反应中
,黑磷),该反应中 的固态白磷转化为固态黑磷,放出
的固态白磷转化为固态黑磷,放出 的热量;
的热量;
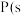 ,白磷)
,白磷) ,红磷),该反应中
,红磷),该反应中 的固态白磷转化为固态红磷,放出
的固态白磷转化为固态红磷,放出 的热量;
的热量;
由此推知,其中最稳定的磷单质是___________ 。
②比较氮和磷氢化物的热稳定性:
___________  (填“
(填“ ”“
”“ ”);写出
”);写出 结构式
结构式___________ 。
③ 与卤化氢的反应和
与卤化氢的反应和 与卤化氢的反应相似,产物的结构和性质也相似。
与卤化氢的反应相似,产物的结构和性质也相似。
下列对 与
与 反应产物的推断正确的是
反应产物的推断正确的是___________ (填序号)。
 不能与
不能与 反应
反应  含离子键、共价键
含离子键、共价键  受热易分解
受热易分解
(3)已知 溶于水后的电离方程式为
溶于水后的电离方程式为 ,若分别向上述混合体系中加入稀硫酸、
,若分别向上述混合体系中加入稀硫酸、 溶液,则生成的正盐的化学式分别为
溶液,则生成的正盐的化学式分别为___________ 、___________ 。
(4) 能与水以等物质的量之比发生较强烈的反应,生成难溶的
能与水以等物质的量之比发生较强烈的反应,生成难溶的 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(5)某工厂采用辉铋矿(主要成分为 ,含有
,含有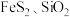 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制备
)联合焙烧法制备 和
和 ,工艺流程如图所示:
,工艺流程如图所示: 分解为
分解为 转变为
转变为 ;
;
②金属活动性: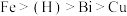 ;
;
③相关金属离子形成氢氧化物的 范围如下:
范围如下:
① 在元素周期表中的位置是
在元素周期表中的位置是___________ ,基态原子价层电子排布式为___________ 。
② 在空气中单独焙烧生成
在空气中单独焙烧生成 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
③滤渣的主要成分为___________ (填化学式)。
④生成气体 的离子方程式为
的离子方程式为___________ 。
⑤加入金属 的目的是
的目的是___________ 。
 、锑
、锑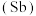 、铋
、铋 、镆
、镆 为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
为元素周期表中原子序数依次增大的同主族元素。回答下列问题:(1)
 中
中 键和
键和 键的数目比例是
键的数目比例是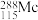 的中子数为
的中子数为(2)①已知
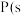 ,白磷)
,白磷) ,黑磷),该反应中
,黑磷),该反应中 的固态白磷转化为固态黑磷,放出
的固态白磷转化为固态黑磷,放出 的热量;
的热量;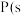 ,白磷)
,白磷) ,红磷),该反应中
,红磷),该反应中 的固态白磷转化为固态红磷,放出
的固态白磷转化为固态红磷,放出 的热量;
的热量;由此推知,其中最稳定的磷单质是
②比较氮和磷氢化物的热稳定性:

 (填“
(填“ ”“
”“ ”);写出
”);写出 结构式
结构式③
 与卤化氢的反应和
与卤化氢的反应和 与卤化氢的反应相似,产物的结构和性质也相似。
与卤化氢的反应相似,产物的结构和性质也相似。下列对
 与
与 反应产物的推断正确的是
反应产物的推断正确的是 不能与
不能与 反应
反应  含离子键、共价键
含离子键、共价键  受热易分解
受热易分解(3)已知
 溶于水后的电离方程式为
溶于水后的电离方程式为 ,若分别向上述混合体系中加入稀硫酸、
,若分别向上述混合体系中加入稀硫酸、 溶液,则生成的正盐的化学式分别为
溶液,则生成的正盐的化学式分别为(4)
 能与水以等物质的量之比发生较强烈的反应,生成难溶的
能与水以等物质的量之比发生较强烈的反应,生成难溶的 ,写出该反应的化学方程式
,写出该反应的化学方程式(5)某工厂采用辉铋矿(主要成分为
 ,含有
,含有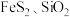 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制备
)联合焙烧法制备 和
和 ,工艺流程如图所示:
,工艺流程如图所示:
 分解为
分解为 转变为
转变为 ;
;②金属活动性:
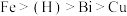 ;
;③相关金属离子形成氢氧化物的
 范围如下:
范围如下:开始沉淀 | 完全沉淀 | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
 在元素周期表中的位置是
在元素周期表中的位置是②
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,该反应的化学方程式为
,该反应的化学方程式为③滤渣的主要成分为
④生成气体
 的离子方程式为
的离子方程式为⑤加入金属
 的目的是
的目的是
您最近半年使用:0次
名校
解题方法
2 . 氧化铬( )主要用于冶炼金属铬、有机化学合成的催化剂等。工业上以铬铁矿[主要成份:
)主要用于冶炼金属铬、有机化学合成的催化剂等。工业上以铬铁矿[主要成份: (亚铬酸亚铁),还含有
(亚铬酸亚铁),还含有 等杂质]为主要原料进行生产,其主要工艺流程如下:
等杂质]为主要原料进行生产,其主要工艺流程如下:
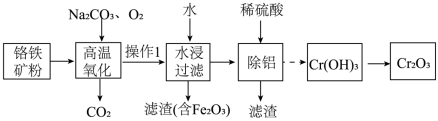
(1)基态 的核外电子排布式为
的核外电子排布式为_______ 。S8与热的浓NaOH溶液反应的产物之一为Na2S3,S 的空间结构为
的空间结构为_______ 。
(2)“高温氧化”过程中 转化为
转化为 的化学方程式为
的化学方程式为_______ 。
(3)“操作1”是将固体冷却、研磨,再加水浸取,其中研磨的目是_______ 。
(4)为获得纯净 ,需判断
,需判断 是否洗涤干净。该操作是
是否洗涤干净。该操作是_______ 。
(5)现用FeS模拟工业上处理含铬废水( )(浓度
)(浓度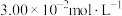 ),处理后所得滤渣主要成分为FeOOH,
),处理后所得滤渣主要成分为FeOOH, ,FeS。(已知:S元素被氧化为可溶性硫酸盐)
,FeS。(已知:S元素被氧化为可溶性硫酸盐)
①将滤渣用蒸馏水洗净后,在低温条件下干燥,将干燥后的固体在空气中加热,测得固体质量随温度的变化如图所示。
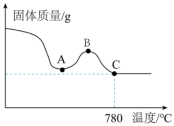
说明:780℃以上的残留固体为 、
、 的混合物。
的混合物。
A→B固体质量增加的原因是_______ 。
②IL的“废水”可氧化的FeS的质量为_______ g。
 )主要用于冶炼金属铬、有机化学合成的催化剂等。工业上以铬铁矿[主要成份:
)主要用于冶炼金属铬、有机化学合成的催化剂等。工业上以铬铁矿[主要成份: (亚铬酸亚铁),还含有
(亚铬酸亚铁),还含有 等杂质]为主要原料进行生产,其主要工艺流程如下:
等杂质]为主要原料进行生产,其主要工艺流程如下:
(1)基态
 的核外电子排布式为
的核外电子排布式为 的空间结构为
的空间结构为(2)“高温氧化”过程中
 转化为
转化为 的化学方程式为
的化学方程式为(3)“操作1”是将固体冷却、研磨,再加水浸取,其中研磨的目是
(4)为获得纯净
 ,需判断
,需判断 是否洗涤干净。该操作是
是否洗涤干净。该操作是(5)现用FeS模拟工业上处理含铬废水(
 )(浓度
)(浓度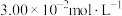 ),处理后所得滤渣主要成分为FeOOH,
),处理后所得滤渣主要成分为FeOOH, ,FeS。(已知:S元素被氧化为可溶性硫酸盐)
,FeS。(已知:S元素被氧化为可溶性硫酸盐)①将滤渣用蒸馏水洗净后,在低温条件下干燥,将干燥后的固体在空气中加热,测得固体质量随温度的变化如图所示。

说明:780℃以上的残留固体为
 、
、 的混合物。
的混合物。A→B固体质量增加的原因是
②IL的“废水”可氧化的FeS的质量为
您最近半年使用:0次
解题方法
3 . 已知硼、氮、铜是几种重要的元素,请回答下列问题:
(1)Cu的基态原子的电子排布式为______ 。
(2)Cu的配合物A的结构如图,A中所含C、N、O三种元素的第一电离能由大到小的顺序为______ ,配合物A中碳原子的杂化方式为______ 。

(3)配体氨基乙酸根(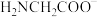 )受热分解可产生CO2和N2,N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为
)受热分解可产生CO2和N2,N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为______ 。
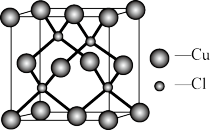
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。
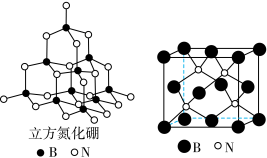
①晶胞中每个氮原子周围与其最近且等距离的硼原子有______ 个。
②结构化学用原子坐标参数表示晶胞内各原子的相对位置,立方氮化硼的晶胞中,B原子坐标参数分别有: ;
; ;
;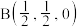 等,则距离上述三个B原子最近且等距离的N原子的坐标参数为
等,则距离上述三个B原子最近且等距离的N原子的坐标参数为______ 。
③氮化硼晶体的化学式为______ ,晶体类型为______ 。
(1)Cu的基态原子的电子排布式为
(2)Cu的配合物A的结构如图,A中所含C、N、O三种元素的第一电离能由大到小的顺序为

(3)配体氨基乙酸根(
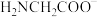 )受热分解可产生CO2和N2,N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为
)受热分解可产生CO2和N2,N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。

①晶胞中每个氮原子周围与其最近且等距离的硼原子有
②结构化学用原子坐标参数表示晶胞内各原子的相对位置,立方氮化硼的晶胞中,B原子坐标参数分别有:
 ;
; ;
;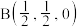 等,则距离上述三个B原子最近且等距离的N原子的坐标参数为
等,则距离上述三个B原子最近且等距离的N原子的坐标参数为③氮化硼晶体的化学式为
您最近半年使用:0次
解题方法
4 . 碱式碳酸铜[2CuCO3·Cu(OH)2]可用于制造烟火等。在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成。
(1)Cu2+基态核外电子排布式为___________ 。
(2)Cu2+在溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的。1 mol[Cu(H2O)4]2+中含有σ键的数目为___________ 。
(3)CO 中C原子轨道杂化类型为
中C原子轨道杂化类型为___________ ;与CO2互为等电子体的一种阴离子为___________ (填化学式)。
(4)NO 的空间构型为
的空间构型为___________ (用文字描述)。
(5)Cu的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是___________ 。
(1)Cu2+基态核外电子排布式为
(2)Cu2+在溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的。1 mol[Cu(H2O)4]2+中含有σ键的数目为
(3)CO
 中C原子轨道杂化类型为
中C原子轨道杂化类型为(4)NO
 的空间构型为
的空间构型为(5)Cu的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是

您最近半年使用:0次
解题方法
5 . 废水中 会带来环境污染问题,用微生物法和铁炭法均可将
会带来环境污染问题,用微生物法和铁炭法均可将 还原脱除。
还原脱除。
(1)微生物法脱硫
富含有机物的弱酸性废水在微生物作用下产生CH3COOH、H2等物质,可将废水中 还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。
还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。
① 的空间构型为
的空间构型为_______ 。
②CH3COOH与 在SBR细菌作用下生成CO2和H2S的离子方程式为
在SBR细菌作用下生成CO2和H2S的离子方程式为_______ 。
③将H2S从水中吹出时,用CO2比N2效果更好,其原因是_______ 。
(2)铁炭法脱硫
铁炭混合物(铁屑与活性炭的混合物)在酸性废水中产生原子态H,可将废水中的 转化为硫化物沉淀除去。
转化为硫化物沉淀除去。
①废水中 转化为硫化物而除去,该硫化物的化学式为
转化为硫化物而除去,该硫化物的化学式为_______ 。
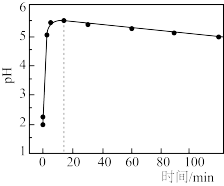
②为提高铁炭混合物处理效果常通入少量空气,反应过程中废水pH随时间变化如图所示。反应进行15 min后溶液pH缓慢下降的原因可能是_______ 。
(3)处理后废水中 含量测定
含量测定
准确量取50.00 mL水样于锥形瓶中,加入10.00 mL 0.0500 mol·L-1BaCl2溶液,充分反应后,滴加氨水调节溶液pH= 10,用0.0100 mol·L-1 EDTA (Na2H2Y) 溶液滴定至终点,滴定反应为:Ba2++H2Y2- =BaY2-+2H+,平行滴定3次,平均消耗EDTA溶液27.50 mL。计算处理后水样中 含量
含量_______ 。(用mg·L-1表示,写出计算过程)。
 会带来环境污染问题,用微生物法和铁炭法均可将
会带来环境污染问题,用微生物法和铁炭法均可将 还原脱除。
还原脱除。(1)微生物法脱硫
富含有机物的弱酸性废水在微生物作用下产生CH3COOH、H2等物质,可将废水中
 还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。
还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。①
 的空间构型为
的空间构型为②CH3COOH与
 在SBR细菌作用下生成CO2和H2S的离子方程式为
在SBR细菌作用下生成CO2和H2S的离子方程式为③将H2S从水中吹出时,用CO2比N2效果更好,其原因是
(2)铁炭法脱硫
铁炭混合物(铁屑与活性炭的混合物)在酸性废水中产生原子态H,可将废水中的
 转化为硫化物沉淀除去。
转化为硫化物沉淀除去。①废水中
 转化为硫化物而除去,该硫化物的化学式为
转化为硫化物而除去,该硫化物的化学式为②为提高铁炭混合物处理效果常通入少量空气,反应过程中废水pH随时间变化如图所示。反应进行15 min后溶液pH缓慢下降的原因可能是

(3)处理后废水中
 含量测定
含量测定准确量取50.00 mL水样于锥形瓶中,加入10.00 mL 0.0500 mol·L-1BaCl2溶液,充分反应后,滴加氨水调节溶液pH= 10,用0.0100 mol·L-1 EDTA (Na2H2Y) 溶液滴定至终点,滴定反应为:Ba2++H2Y2- =BaY2-+2H+,平行滴定3次,平均消耗EDTA溶液27.50 mL。计算处理后水样中
 含量
含量
您最近半年使用:0次
2022-05-07更新
|
938次组卷
|
6卷引用:江苏省苏锡常镇四市2022届高三下学期教学情况调研(二)化学试题
江苏省苏锡常镇四市2022届高三下学期教学情况调研(二)化学试题江苏省苏锡常镇四市2021-2022学年高三下学期5月教学情况调研(二)化学试题 (已下线)2022年江苏卷高考真题变式题14-17(已下线)江苏省2022年普通高中学业水平选择性考试变式题(结构与性质)(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(结构与性质)
名校
解题方法
6 . 原子序数依次增大且小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的3倍,Z与Y同族,Q原子基态时3p原子轨道上有1个未成对的电子,W的原子序数为29。回答下列问题:
(1)X2Y2分子中Y原子轨道的杂化类型为____ 。
(2)化合物沸点比较:X2Y____ X2Z,其原因是____ 。
(3)元素Z最高价氧化物对应水化物的阴离子空间构型为____ ,与该离子互为等电子体且含有Q元素的一种分子的分子式是____ 。
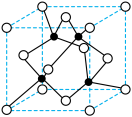
(4)W基态原子的核外电子排布式是____ ,元素W的一种氯化物晶体的晶胞结构如下图所示,该氯化物的化学式是____ 。
(1)X2Y2分子中Y原子轨道的杂化类型为
(2)化合物沸点比较:X2Y
(3)元素Z最高价氧化物对应水化物的阴离子空间构型为
(4)W基态原子的核外电子排布式是

您最近半年使用:0次



