真题
解题方法
1 . 含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为_____ 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是____ ,原因是_____ 。
(3)SnCl 的几何构型为
的几何构型为____ ,其中心离子杂化方式为____ 。
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是____ (填标号)。
(5)如图是硫的四种含氧酸根的结构:
A. B.
B. 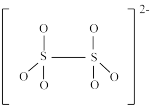 C.
C.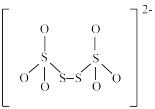 D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO 的是
的是____ (填标号),理由是____ 。
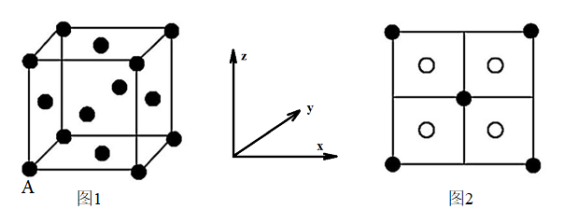
(6)如图是CZTS四元半导体化合物的四方晶胞。
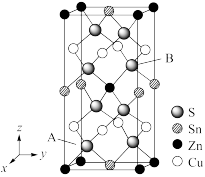
①该物质的化学式为_____ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( ,
, ,
, ),则B原子的坐标为
),则B原子的坐标为_____ 。
(1)基态S原子的价电子中,两种自旋状态的电子数之比为
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是
(3)SnCl
 的几何构型为
的几何构型为(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是
| A.[Cu(NH3)2]Cl | B.[Cu(NH3)4]SO4 | C.[Zn(NH3)4]SO4 | D.Na2[Zn(OH)4] |
A.
 B.
B.  C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO
 的是
的是(6)如图是CZTS四元半导体化合物的四方晶胞。

①该物质的化学式为
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为(
 ,
, ,
, ),则B原子的坐标为
),则B原子的坐标为
您最近半年使用:0次
真题
名校
2 . 三磷酸腺苷(ATP) 和活性氧类(如 H2O2和O )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。
(1)ATP 的分子式为C10H16N5O13P3,其中电负性最大的元素是_______ ,基态 N原子的电子排布图为_______ 。
(2)H2O2 分子的氧原子的杂化轨道类型为:_______ ;H2O2和H2O能以任意比例互溶的原因是_______ 。
(3)O3分子的立体构型为_______ 。根据表中数据判断氧原子之间的共价键最稳定的粒子是_______ 。
(4)研究发现纳米CeO2可催化O 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。
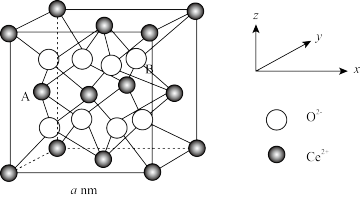
①阿伏加德罗常数的值为NA,CeO2相对分子质量为M,晶体密度为ρg·cm-3,其晶胞边长的计量表达式为a=_______ nm。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0, ,
, ),则B离子的坐标为
),则B离子的坐标为_______ 。
③纳米CeO2中位于晶粒表面的Ce4+能发挥催化作用,在边长为2 a nm的立方体晶粒中位于表面的Ce4+最多有_______ 个。
 )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。(1)ATP 的分子式为C10H16N5O13P3,其中电负性最大的元素是
(2)H2O2 分子的氧原子的杂化轨道类型为:
(3)O3分子的立体构型为
| 粒子 | O2 | O | O3 |
| 键长/pm | 121 | 126 | 128 |
 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。
①阿伏加德罗常数的值为NA,CeO2相对分子质量为M,晶体密度为ρg·cm-3,其晶胞边长的计量表达式为a=
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0,
 ,
, ),则B离子的坐标为
),则B离子的坐标为③纳米CeO2中位于晶粒表面的Ce4+能发挥催化作用,在边长为2 a nm的立方体晶粒中位于表面的Ce4+最多有
您最近半年使用:0次
2022-05-27更新
|
4786次组卷
|
5卷引用:重庆市2021年高考真题化学试题
重庆市2021年高考真题化学试题四川省内江市第六中学2022-2023学年高二下学期期中考试化学试题(已下线)专题20 结构与性质(已下线)专题20 结构与性质宁夏回族自治区石嘴山市平罗中学2023-2024学年高三上学期第四次月考理科综合试题
解题方法
3 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)Ag元素在元素周期表分区中属于_______ 区,基态Ag原子的价电子排布式为_______ 。
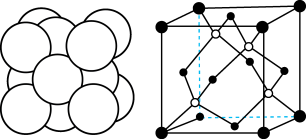
(2)硫代硫酸银(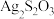 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。
①依据 理论推测
理论推测 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
②在 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ 。
(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
_______  (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是_______ 。
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.电荷因素 c.键性因素
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______ ;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______ (储氢能力 )
)
(1)Ag元素在元素周期表分区中属于
(2)硫代硫酸银(
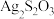 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。①依据
 理论推测
理论推测 的空间构型为
的空间构型为②在
 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有
 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为a.几何因素 b.电荷因素 c.键性因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为
 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为 )
)
您最近半年使用:0次
2022-04-25更新
|
1241次组卷
|
4卷引用:内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题
内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)【直抵名校】01-备战2022年高考化学名校进阶模拟卷(通用版)河南省南阳市2021-2022学年高二下学期期末考试化学试题
4 . 2022年春晚中舞蹈诗剧《只此青绿》生动还原了北宋名画,《千里江山图》之所以色彩艳丽,璀璨夺目,与所使用矿物颜料有关。回答下列问题:
(1)石青,又名蓝矿石,化学式为 ,基态
,基态 核外电子的空间运动状态有
核外电子的空间运动状态有______ 种, 的空间构型为
的空间构型为________ 。原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则
表示,称为电子的自旋磁量子数,则 中电子自旋磁量子数的代数和为
中电子自旋磁量子数的代数和为________ 。
(2)亚铁氰化钾,化学式为 ,呈黄色结晶性粉末。
,呈黄色结晶性粉末。 中配体
中配体 的配位原子是
的配位原子是________ (填元素符号), 中C原子的杂化方式
中C原子的杂化方式_______ , 中σ键和π键的数目之比为
中σ键和π键的数目之比为________ 。
(3) 呈黑色或灰黑色,已知:晶胞中
呈黑色或灰黑色,已知:晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞的侧视图如图2所示。
所构成的四面体中心,晶胞的侧视图如图2所示。
 填充了晶胞中四面体空隙的百分率是
填充了晶胞中四面体空隙的百分率是______ , 配位数为
配位数为________ 。已知图1中A原子的原子分数坐标为(0,0,0),则与A原子距离最近的 的原子分数坐标为
的原子分数坐标为________ 。若晶胞参数anm,晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为________ (用含a和d的式子表示)。
(1)石青,又名蓝矿石,化学式为
 ,基态
,基态 核外电子的空间运动状态有
核外电子的空间运动状态有 的空间构型为
的空间构型为 和
和 表示,称为电子的自旋磁量子数,则
表示,称为电子的自旋磁量子数,则 中电子自旋磁量子数的代数和为
中电子自旋磁量子数的代数和为(2)亚铁氰化钾,化学式为
 ,呈黄色结晶性粉末。
,呈黄色结晶性粉末。 中配体
中配体 的配位原子是
的配位原子是 中C原子的杂化方式
中C原子的杂化方式 中σ键和π键的数目之比为
中σ键和π键的数目之比为(3)
 呈黑色或灰黑色,已知:晶胞中
呈黑色或灰黑色,已知:晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞的侧视图如图2所示。
所构成的四面体中心,晶胞的侧视图如图2所示。
 填充了晶胞中四面体空隙的百分率是
填充了晶胞中四面体空隙的百分率是 配位数为
配位数为 的原子分数坐标为
的原子分数坐标为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近半年使用:0次
2022-03-06更新
|
1122次组卷
|
3卷引用:山东省日照市 2022届高三第一次模拟考试化学试题
山东省日照市 2022届高三第一次模拟考试化学试题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-测试福建省连城县第一中学2022-2023学年高三上学期第二次月考化学试题
解题方法
5 . 废水中 会带来环境污染问题,用微生物法和铁炭法均可将
会带来环境污染问题,用微生物法和铁炭法均可将 还原脱除。
还原脱除。
(1)微生物法脱硫
富含有机物的弱酸性废水在微生物作用下产生CH3COOH、H2等物质,可将废水中 还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。
还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。
① 的空间构型为
的空间构型为_______ 。
②CH3COOH与 在SBR细菌作用下生成CO2和H2S的离子方程式为
在SBR细菌作用下生成CO2和H2S的离子方程式为_______ 。
③将H2S从水中吹出时,用CO2比N2效果更好,其原因是_______ 。
(2)铁炭法脱硫
铁炭混合物(铁屑与活性炭的混合物)在酸性废水中产生原子态H,可将废水中的 转化为硫化物沉淀除去。
转化为硫化物沉淀除去。
①废水中 转化为硫化物而除去,该硫化物的化学式为
转化为硫化物而除去,该硫化物的化学式为_______ 。
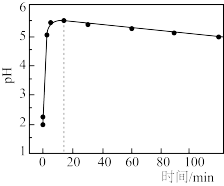
②为提高铁炭混合物处理效果常通入少量空气,反应过程中废水pH随时间变化如图所示。反应进行15 min后溶液pH缓慢下降的原因可能是_______ 。
(3)处理后废水中 含量测定
含量测定
准确量取50.00 mL水样于锥形瓶中,加入10.00 mL 0.0500 mol·L-1BaCl2溶液,充分反应后,滴加氨水调节溶液pH= 10,用0.0100 mol·L-1 EDTA (Na2H2Y) 溶液滴定至终点,滴定反应为:Ba2++H2Y2- =BaY2-+2H+,平行滴定3次,平均消耗EDTA溶液27.50 mL。计算处理后水样中 含量
含量_______ 。(用mg·L-1表示,写出计算过程)。
 会带来环境污染问题,用微生物法和铁炭法均可将
会带来环境污染问题,用微生物法和铁炭法均可将 还原脱除。
还原脱除。(1)微生物法脱硫
富含有机物的弱酸性废水在微生物作用下产生CH3COOH、H2等物质,可将废水中
 还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。
还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。①
 的空间构型为
的空间构型为②CH3COOH与
 在SBR细菌作用下生成CO2和H2S的离子方程式为
在SBR细菌作用下生成CO2和H2S的离子方程式为③将H2S从水中吹出时,用CO2比N2效果更好,其原因是
(2)铁炭法脱硫
铁炭混合物(铁屑与活性炭的混合物)在酸性废水中产生原子态H,可将废水中的
 转化为硫化物沉淀除去。
转化为硫化物沉淀除去。①废水中
 转化为硫化物而除去,该硫化物的化学式为
转化为硫化物而除去,该硫化物的化学式为②为提高铁炭混合物处理效果常通入少量空气,反应过程中废水pH随时间变化如图所示。反应进行15 min后溶液pH缓慢下降的原因可能是

(3)处理后废水中
 含量测定
含量测定准确量取50.00 mL水样于锥形瓶中,加入10.00 mL 0.0500 mol·L-1BaCl2溶液,充分反应后,滴加氨水调节溶液pH= 10,用0.0100 mol·L-1 EDTA (Na2H2Y) 溶液滴定至终点,滴定反应为:Ba2++H2Y2- =BaY2-+2H+,平行滴定3次,平均消耗EDTA溶液27.50 mL。计算处理后水样中
 含量
含量
您最近半年使用:0次
2022-05-07更新
|
938次组卷
|
6卷引用:江苏省苏锡常镇四市2022届高三下学期教学情况调研(二)化学试题
江苏省苏锡常镇四市2022届高三下学期教学情况调研(二)化学试题江苏省苏锡常镇四市2021-2022学年高三下学期5月教学情况调研(二)化学试题 (已下线)2022年江苏卷高考真题变式题14-17(已下线)2022年北京高考真题变式题1-14(已下线)江苏省2022年普通高中学业水平选择性考试变式题(结构与性质)(已下线)2022年北京高考真题化学试题变式题(结构与性质)
名校
解题方法
6 . 主族元素N、F、Si、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于_______ 晶体;SiCl4中Si采取的杂化类型为_______ 。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点低于Cl2O,原因是_______ 。
(3)Se元素基态原子的原子核外电子排布式为_______ ;As的第一电离能比Se的第一电离能大的原因为_______ 。
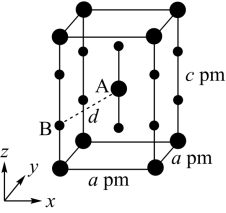
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ ;晶胞中A、B间距离d=_______ pm。
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于
(2)O、F、Cl电负性由大到小的顺序为
(3)Se元素基态原子的原子核外电子排布式为
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近半年使用:0次
2022-05-02更新
|
855次组卷
|
7卷引用:陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题
陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
7 . 氯吡苯脲是一种常用的膨大剂,其结构简式如图,它是经国家批准使用的植物生长调节剂。
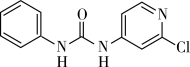
(1)氯元素基态原子核外电子的未成对电子数为_______ 。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为_______ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如图:

反应过程中,每生成1mol氯吡苯脲,断裂_______ 个 键,断裂
键,断裂_______ 个 键。
键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为_______
②NH3分子的空间结构是_______ ,H2O中心原子的杂化类型是_______

(1)氯元素基态原子核外电子的未成对电子数为
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如图:

反应过程中,每生成1mol氯吡苯脲,断裂
 键,断裂
键,断裂 键。
键。(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为
②NH3分子的空间结构是
您最近半年使用:0次
名校
解题方法
8 . 磷、碳、氢等非金属及其化合物用途广泛。试回答下列问题。
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为___________ 。
②研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为___________ ,产生的阳离子的空间结构为___________ ;N和P都有+5价,但NCl5不存在,从原子结构的角度分析其原因:___________ 。
(2)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为  )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为___________ ,一定在同一平面上的原子有___________ 个;乙醇显中性而苯酚显酸性的原因是:在大π键中氧的p电子云向苯环转移,___________ 。
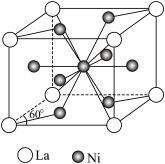
(3)镍镧合金(LaNin)具有很强的储氢能力,其晶胞结构如图所示,其中n=___________ 。 已知晶胞体积为9.0 ×10 -29 m3,若储氢后形成LaNinH5.5(氢进入晶胞空隙,晶胞体积不变),则氢在合金中的密度为___________ g·cm-3(保留1位小数)。
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为
②研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为  )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为(3)镍镧合金(LaNin)具有很强的储氢能力,其晶胞结构如图所示,其中n=
您最近半年使用:0次
2023-04-05更新
|
718次组卷
|
4卷引用:河南省普通高中2023届高三适应性考试理科综合化学试题
河南省普通高中2023届高三适应性考试理科综合化学试题(已下线)化学-2023年高考押题预测卷01(全国乙卷)(含考试版、全解全析、参考答案、答题卡)(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)2024届陕西省西安中学高三下学期第九次模拟考试理综试题-高中化学
名校
解题方法
9 . 2022年春晚节目《只此青绿》取材于宋代名画《千里江山图》,该画描绘了山清水秀的美丽景色,历经千年色彩依然,其中青色来自蓝铜矿颜料[主要成分为Cu3(CO3)2(OH)2]。请回答下列问题:
(1)基态铜原子价电子排布式为_______ 。从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)_______ I2(Cu) (填“>”“<”或“=”),并解释有关原因_______ 。
(2) 的空间构型为
的空间构型为_______ 。
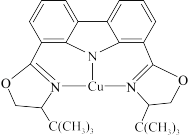
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是_______ (填元素符号),该配合物中采用sp2杂化的碳原子与sp3杂化的碳原子个数比为_______ 。
(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。
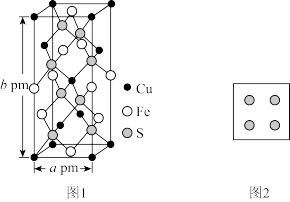
①Fe3+周围距离最近的S2-的个数为_______ 。
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为_______ mol-1(用a、b、ρ表示,并化成最简)。
(1)基态铜原子价电子排布式为
(2)
 的空间构型为
的空间构型为(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是

(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。

①Fe3+周围距离最近的S2-的个数为
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为
您最近半年使用:0次
2022-05-04更新
|
730次组卷
|
4卷引用:安徽省淮北市2022届高三第二次模拟考试理科综合化学试题
安徽省淮北市2022届高三第二次模拟考试理科综合化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)山东省菏泽市单县第二中学2021-2022学年高二下学期慧光班段考化学试题四川省南充高级中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
10 . 碳氮硫共脱除工艺可以协同除去工业废水中的S2-、NO 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
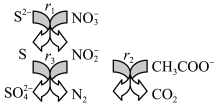
 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
| A.N2和CO2都是非极性分子 |
B.NO 和NO 和NO 的空间构型相同 的空间构型相同 |
C.NO 中存在离域π键 中存在离域π键 |
| D.冰醋酸中CH3COOH分子间存在范德华力和氢键 |
您最近半年使用:0次
2023-01-15更新
|
576次组卷
|
4卷引用:山东省潍坊市2022-2023学年高三上学期期末考试化学试题



