解题方法
1 . 回答下列问题
(1)选择题(题目给出的四个选项中,有两个 选项是符合题目要求的)下列关于晶体的说法中,不正确 的是_____
(2)黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:2CuFeS2 + O2 = Cu2S + 2FeS + SO2。
①Fe在周期表中的位置为_______ ;Fe、S、O原子的第一电离能由大到小的顺序是_______ 。
②Cu元素的基态原子的电子排布式为_______ ,有_______ 个未成对电子。
③SO2分子的立体构型为_______ ,SO2可氧化生成SO3,SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______ 。

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因_______ 。
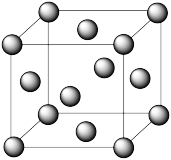
⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有_______ 个,晶胞的边长为_______ (用含ρ和NA的式子表示)。
(1)选择题(题目给出的四个选项中,有
| A.MgO的晶格能远比NaCl大,这是因为前者粒子所带的电荷多,粒子半径小 |
| B.第一电离能:Cl>S>P>Si |
| C.金属原子在二维平面里放置得到非密置层和密置层两种方式,配位数分别为4和6 |
| D.共价键可决定分子晶体的熔、沸点 |
①Fe在周期表中的位置为
②Cu元素的基态原子的电子排布式为
③SO2分子的立体构型为

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因

⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有
您最近一年使用:0次
解题方法
2 . H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题:
(1)N、O、Na原子第一电离能由小到大的顺序是_______ (用元素符号和“<”表示); Cu原子的价电子排布图为_______ 。
(2)Fe3+、Cu2+基态的核外电子排布式中未成对电子数最多的是_______ ; Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为_______ ,水分子与铜离子间结合的化学键名称为_______ 。
(3)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是_______ (填序号)。
①H3O+②H2O ③NO
(4)(CN)2分子中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为_______ ,1个分子中含有_______ 个π键;则(CN)2中C原子的杂化类型为_______ 。
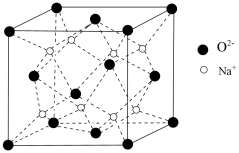
(5)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为_______ ;已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=_______ cm。(用含p、NA的代数式表示)
(1)N、O、Na原子第一电离能由小到大的顺序是
(2)Fe3+、Cu2+基态的核外电子排布式中未成对电子数最多的是
(3)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是
①H3O+②H2O ③NO
(4)(CN)2分子中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为
(5)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为

您最近一年使用:0次
3 . 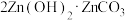 是制备活性
是制备活性 的中间体,以锌焙砂(主要成分为
的中间体,以锌焙砂(主要成分为 ,含少量
,含少量 、
、 等离子)为原料制备
等离子)为原料制备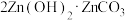 的工艺流程如下:
的工艺流程如下:
请回答下列问题:
(1)基态 的价层电子轨道表示式为
的价层电子轨道表示式为___________ 。
(2) 的电子式为
的电子式为___________ , 的空间构型为
的空间构型为___________ 。
(3)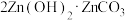 组成的非金属元素第一电离能由大到小的顺序为
组成的非金属元素第一电离能由大到小的顺序为___________ 。
(4)当 ,
, 的混合溶液呈中性时,
的混合溶液呈中性时,
___________  (填“>”“<”或“=”)性。
(填“>”“<”或“=”)性。
(5)“浸取”时为了提高锌的浸出率,可采取的措施是___________ (任写一种)。
(6)“过滤Ⅲ”所得滤液可循环使用,其主要成分的化学式是___________ 。
(7)“浸取”时加入的 过量,生成
过量,生成 的离子方程式为
的离子方程式为___________ 。
(8)“沉锌”的离子方程式为___________ 。
(9)适量 能将
能将 等离子转化为硫化物沉淀而除去,若选择
等离子转化为硫化物沉淀而除去,若选择 进行除杂,是否可行?
进行除杂,是否可行?___________ (填“是”或“否”),[已知: ,
, ;
;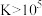 化学反应完全,
化学反应完全,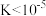 化学反应不发生]用计算说明原因
化学反应不发生]用计算说明原因___________ 。
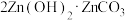 是制备活性
是制备活性 的中间体,以锌焙砂(主要成分为
的中间体,以锌焙砂(主要成分为 ,含少量
,含少量 、
、 等离子)为原料制备
等离子)为原料制备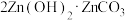 的工艺流程如下:
的工艺流程如下:
请回答下列问题:
(1)基态
 的价层电子轨道表示式为
的价层电子轨道表示式为(2)
 的电子式为
的电子式为 的空间构型为
的空间构型为(3)
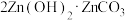 组成的非金属元素第一电离能由大到小的顺序为
组成的非金属元素第一电离能由大到小的顺序为(4)当
 ,
, 的混合溶液呈中性时,
的混合溶液呈中性时,
 (填“>”“<”或“=”)性。
(填“>”“<”或“=”)性。(5)“浸取”时为了提高锌的浸出率,可采取的措施是
(6)“过滤Ⅲ”所得滤液可循环使用,其主要成分的化学式是
(7)“浸取”时加入的
 过量,生成
过量,生成 的离子方程式为
的离子方程式为(8)“沉锌”的离子方程式为
(9)适量
 能将
能将 等离子转化为硫化物沉淀而除去,若选择
等离子转化为硫化物沉淀而除去,若选择 进行除杂,是否可行?
进行除杂,是否可行? ,
, ;
;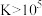 化学反应完全,
化学反应完全,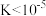 化学反应不发生]用计算说明原因
化学反应不发生]用计算说明原因
您最近一年使用:0次
名校
解题方法
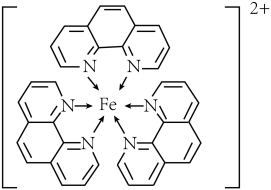
4 . 铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁离子的价电子排布式为_______ 。铁、钴、镍的基态原子核外未成对电子数最多的是_______ 。
(2) 溶于氨水并通入空气,可从溶液中结晶出橙黄色的
溶于氨水并通入空气,可从溶液中结晶出橙黄色的 晶体。该配合物中配体分子的立体构型是
晶体。该配合物中配体分子的立体构型是_______ ,其中心原子的杂化轨道类型为_______ 。
(3)铁、镍易与 作用形成羰基配合物
作用形成羰基配合物 ,
, 的熔点为
的熔点为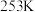 ,沸点为
,沸点为 ,则
,则 固体属于
固体属于_______ 晶体,其中存在的化学键类型为_______ 。
(4)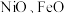 的晶体结构类型与氯化钠的相同,
的晶体结构类型与氯化钠的相同, 和
和 的离子半径分别为
的离子半径分别为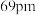 和
和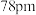 ,则熔点:
,则熔点:
_____ (填“>”“<”或“=”) ,原因是
,原因是______ 。
(5) 晶体中,
晶体中, 的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的
的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的 围成的正四面体空隙和3、6、7、8、9、12的
围成的正四面体空隙和3、6、7、8、9、12的 围成的正八面体空隙。
围成的正八面体空隙。 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中,则
填充在正八面体空隙中,则 晶体中,正四面体空隙数与
晶体中,正四面体空隙数与 数之比为
数之比为_______ ,有_______ %的正八面体空隙没有填充阳离子。 晶胞中有8个图示结构单元,晶体密度为
晶胞中有8个图示结构单元,晶体密度为 ,则该晶胞参数
,则该晶胞参数
_______  。(写出表达式)
。(写出表达式)

(1)基态铁离子的价电子排布式为
(2)
 溶于氨水并通入空气,可从溶液中结晶出橙黄色的
溶于氨水并通入空气,可从溶液中结晶出橙黄色的 晶体。该配合物中配体分子的立体构型是
晶体。该配合物中配体分子的立体构型是(3)铁、镍易与
 作用形成羰基配合物
作用形成羰基配合物 ,
, 的熔点为
的熔点为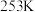 ,沸点为
,沸点为 ,则
,则 固体属于
固体属于(4)
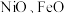 的晶体结构类型与氯化钠的相同,
的晶体结构类型与氯化钠的相同, 和
和 的离子半径分别为
的离子半径分别为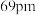 和
和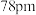 ,则熔点:
,则熔点:
 ,原因是
,原因是(5)
 晶体中,
晶体中, 的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的
的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的 围成的正四面体空隙和3、6、7、8、9、12的
围成的正四面体空隙和3、6、7、8、9、12的 围成的正八面体空隙。
围成的正八面体空隙。 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中,则
填充在正八面体空隙中,则 晶体中,正四面体空隙数与
晶体中,正四面体空隙数与 数之比为
数之比为 晶胞中有8个图示结构单元,晶体密度为
晶胞中有8个图示结构单元,晶体密度为 ,则该晶胞参数
,则该晶胞参数
 。(写出表达式)
。(写出表达式)
您最近一年使用:0次
名校
解题方法
5 . 根据所学物质结构与性质的知识回答下列问题。
(1)超分子化学已逐渐扩展到化学的各个领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
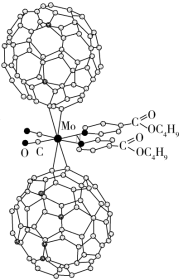
①Mo处于第五周期第VIB族,价电子排布与Cr相似,它的基态价电子排布图是___________ ,该超分子中存在的化学键类型有___________ (填选项字母)。
A.离子键B.氢键C.σ键D.π键
②该超分子中,配体CO提供孤电子对的原子是___________ (填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有___________ 。
(2)氟及其化合物用途非常广泛。
①聚四氟乙烯是一种准晶体,可通过___________ 方法区分晶体、准晶体和非晶体。
②AsF3、IF 、OF2,BeF2中价层电子对数不同于其它微粒的是
、OF2,BeF2中价层电子对数不同于其它微粒的是___________ (填化学式,下同),其立体构型为___________ 。
③室温氟穿梭电池的电解质为氟氢离子液体,含HF 、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式
、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式___________ 。
④基于CaF2设计的Born-Haber循环如图所示。
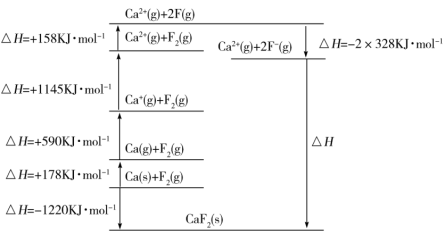
钙的第一电离能为___________ kJ·mol-1;F-F键的键能为___________ kJ·mol-1。
(1)超分子化学已逐渐扩展到化学的各个领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。

①Mo处于第五周期第VIB族,价电子排布与Cr相似,它的基态价电子排布图是
A.离子键B.氢键C.σ键D.π键
②该超分子中,配体CO提供孤电子对的原子是
(2)氟及其化合物用途非常广泛。
①聚四氟乙烯是一种准晶体,可通过
②AsF3、IF
 、OF2,BeF2中价层电子对数不同于其它微粒的是
、OF2,BeF2中价层电子对数不同于其它微粒的是③室温氟穿梭电池的电解质为氟氢离子液体,含HF
 、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式
、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式④基于CaF2设计的Born-Haber循环如图所示。

钙的第一电离能为
您最近一年使用:0次
2021-08-30更新
|
319次组卷
|
2卷引用:山东省济宁市2020-2021学年高二下学期期末考试化学试题
6 . 有A、B、C、D、E五种元素的原子序数依次增大。A、B、C位于同一周期,A原子的第一电离能大于B原子,B原子的2p能级上有两个未成对电子,D位于第四周期且原子的d能级上没有电子,C与D形成的化合物为DC2。E原子的3d能级上电子数是4s能级上电子数的三倍。
(1)写出基态E3+的电子排布式___ 。
(2)A原子第一电离能大于B的原因___ 。
(3)一个A2C2分子中含个___ σ键,___ 个π键;AB 离子的空间构型为
离子的空间构型为___ 。
(4)上述五种元素的原子中电负性由大到小顺序是___ (填元素符号)。
(1)写出基态E3+的电子排布式
(2)A原子第一电离能大于B的原因
(3)一个A2C2分子中含个
 离子的空间构型为
离子的空间构型为(4)上述五种元素的原子中电负性由大到小顺序是
您最近一年使用:0次
名校
解题方法
7 . 氮化亚铜用于制备P型半导体,其可用 、
、 、2-吡咯甲醛作氮源制取。回答下列问题:
、2-吡咯甲醛作氮源制取。回答下列问题:
(1)基态N原子核外电子的电子排布图(轨道表示式)为___________ 。
(2)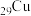 、
、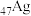 均位于第ⅠB族,基态Ag原子的价电子排布式为
均位于第ⅠB族,基态Ag原子的价电子排布式为___________ ;但铜的熔点和沸点均比银的高,这是由于___________ 。
(3) 的空间结构和
的空间结构和 相同,则
相同,则 的空间结构为
的空间结构为___________ , 的价电子数为
的价电子数为___________ 。
(4)2—吡咯甲醛作氮源制备氮化亚铜的反应过程如下:
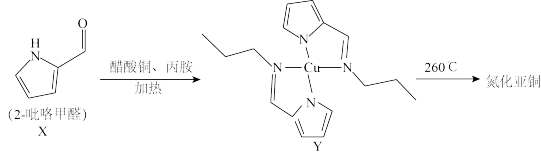
①配合物Y中,Cu的配位数为___________ 。
②基态 中未成对电子数为
中未成对电子数为___________ 。
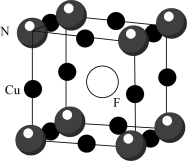
(5)氮化亚铜用氟掺杂可得到P型半导体,其晶胞结构如图所示,晶胞参数为 。则F原子与邻近的N原子间的距离为
。则F原子与邻近的N原子间的距离为___________ pm,设 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  。
。
 、
、 、2-吡咯甲醛作氮源制取。回答下列问题:
、2-吡咯甲醛作氮源制取。回答下列问题:(1)基态N原子核外电子的电子排布图(轨道表示式)为
(2)
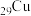 、
、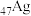 均位于第ⅠB族,基态Ag原子的价电子排布式为
均位于第ⅠB族,基态Ag原子的价电子排布式为(3)
 的空间结构和
的空间结构和 相同,则
相同,则 的空间结构为
的空间结构为 的价电子数为
的价电子数为(4)2—吡咯甲醛作氮源制备氮化亚铜的反应过程如下:

①配合物Y中,Cu的配位数为
②基态
 中未成对电子数为
中未成对电子数为(5)氮化亚铜用氟掺杂可得到P型半导体,其晶胞结构如图所示,晶胞参数为
 。则F原子与邻近的N原子间的距离为
。则F原子与邻近的N原子间的距离为 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
8 . 锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。
(1)基态Ge原子的电子排布式为_______ 。
(2) 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是_______ 分子(填“极性”或“非性极”)。
(3) 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为_______ (用元素符号表示), 中N的杂化方式为
中N的杂化方式为_______ 。
(4)如图所示的化合物,中心离子的配位数为_______ 。
(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:_______ 。
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为_______ ;已知晶胞边长为a pm,阿伏加德罗常数的值为 ,该晶胞密度
,该晶胞密度 为
为_______  (只列出计算式)。
(只列出计算式)。

(1)基态Ge原子的电子排布式为
(2)
 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是(3)
 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为 中N的杂化方式为
中N的杂化方式为(4)如图所示的化合物,中心离子的配位数为

(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为(
 ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为 ,该晶胞密度
,该晶胞密度 为
为 (只列出计算式)。
(只列出计算式)。
您最近一年使用:0次
名校
解题方法
9 . 金属Mn、Co、Ni、Sb等在电池、储氢材料、催化剂等方面有广泛应用。请回答下列问题:
(1)基态Co原子中,核外电子占据的最高能层的符号是_______ ,基态Ni简化的核外电子排布式为_______ 。
(2)铜锰氧化物( CuMn2O4)能在常温下催化氧化甲醛生成甲酸(结构如图)。
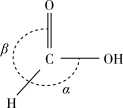
①甲酸的沸点比甲醛的_______ (填“低”或“高”),主要原因是_______ 。
②甲酸分子中O-H键的类型是s-sp3σ键,C-H键的类型是_______ σ键,键角:α_______ β(填“>”“=”或“<”)。
(3)超强酸氟锑酸(结构如图)在化学和化学工业上有很大的应用价值,是活性极高的催化剂。

①该物质中∠FSbF为90°或180° ,则阴离子的空间构型为_______ 。
②阴离子的中心原子的杂化轨道类型是_______ (填序号)。
A. sp3d2 B. sp2 C. sp3 D. sp
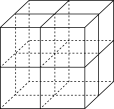
(4)Mg2 NiH4是科学家研究的一种高效固态储氢材料。在Mg2NiH4晶胞中,Ni原子占据如图所示的顶点和面心,Mg2+处于图中八个小立方体的体心。Mg2+和Ni原子的最短距离为d nm,NA为阿伏加德罗常数的值,该晶体的密度为_______ g·cm-3(用含NA、d、M的代数式表示,Mg2NiH4的相对分子质量为M)。
(1)基态Co原子中,核外电子占据的最高能层的符号是
(2)铜锰氧化物( CuMn2O4)能在常温下催化氧化甲醛生成甲酸(结构如图)。

①甲酸的沸点比甲醛的
②甲酸分子中O-H键的类型是s-sp3σ键,C-H键的类型是
(3)超强酸氟锑酸(结构如图)在化学和化学工业上有很大的应用价值,是活性极高的催化剂。

①该物质中∠FSbF为90°或180° ,则阴离子的空间构型为
②阴离子的中心原子的杂化轨道类型是
A. sp3d2 B. sp2 C. sp3 D. sp
(4)Mg2 NiH4是科学家研究的一种高效固态储氢材料。在Mg2NiH4晶胞中,Ni原子占据如图所示的顶点和面心,Mg2+处于图中八个小立方体的体心。Mg2+和Ni原子的最短距离为d nm,NA为阿伏加德罗常数的值,该晶体的密度为

您最近一年使用:0次
2022-05-30更新
|
265次组卷
|
3卷引用:安徽省名校2022届高三毕业班考前定位理科综合化学试题
名校
解题方法
10 . 短周期主族元素X、Y、Z、G、T的原子序数依次增大,Z、G是金属元素且G的氧化物属于两性氧化物,T的原子序数是Y的2倍且T、Y的最低化合价相同。这5种元素的价电子数之和等于20,含Z元素的物质的焰色呈黄色。回答下列问题:
(1)X的最高价氧化物对应水化物的化学式为___________ 。位于元素周期表中s区的元素为___________ (填元素符号)。
(2)Y、Z、G、T的电负性由小到大的顺序为___________ (填元素符号)。
(3) 分子是
分子是___________ (填“极性”或“非极性”)分子。 分子中T的价层电子对数为
分子中T的价层电子对数为___________ 。
(4)Y和Z能形成既含离子键,又含共价键的化合物,其化学式为___________ 。
(5)V是由Y、Z、T组成的化合物,V的水溶液呈中性。则V的阴离子的空间构型___________ 。
(6)T的一种单质的结构如图所示: ,T原子杂化类型是
,T原子杂化类型是________ 。32gT的这种单质含σ键的数目为________ 。这种单质易溶于 ,不溶于水,其原因是
,不溶于水,其原因是_________ 。
(1)X的最高价氧化物对应水化物的化学式为
(2)Y、Z、G、T的电负性由小到大的顺序为
(3)
 分子是
分子是 分子中T的价层电子对数为
分子中T的价层电子对数为(4)Y和Z能形成既含离子键,又含共价键的化合物,其化学式为
(5)V是由Y、Z、T组成的化合物,V的水溶液呈中性。则V的阴离子的空间构型
(6)T的一种单质的结构如图所示:
 ,T原子杂化类型是
,T原子杂化类型是 ,不溶于水,其原因是
,不溶于水,其原因是
您最近一年使用:0次
2023-04-28更新
|
180次组卷
|
3卷引用:江西省南昌市等5地2022-2023学年高二下学期4月期中考试化学试题



