真题
名校
1 . 三磷酸腺苷(ATP) 和活性氧类(如 H2O2和O )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。
(1)ATP 的分子式为C10H16N5O13P3,其中电负性最大的元素是_______ ,基态 N原子的电子排布图为_______ 。
(2)H2O2 分子的氧原子的杂化轨道类型为:_______ ;H2O2和H2O能以任意比例互溶的原因是_______ 。
(3)O3分子的立体构型为_______ 。根据表中数据判断氧原子之间的共价键最稳定的粒子是_______ 。
(4)研究发现纳米CeO2可催化O 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。_______ nm。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0, ,
, ),则B离子的坐标为
),则B离子的坐标为_______ 。
③纳米CeO2中位于晶粒表面的Ce4+能发挥催化作用,在边长为2 a nm的立方体晶粒中位于表面的Ce4+最多有_______ 个。
 )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。(1)ATP 的分子式为C10H16N5O13P3,其中电负性最大的元素是
(2)H2O2 分子的氧原子的杂化轨道类型为:
(3)O3分子的立体构型为
| 粒子 | O2 | O | O3 |
| 键长/pm | 121 | 126 | 128 |
(4)研究发现纳米CeO2可催化O
 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。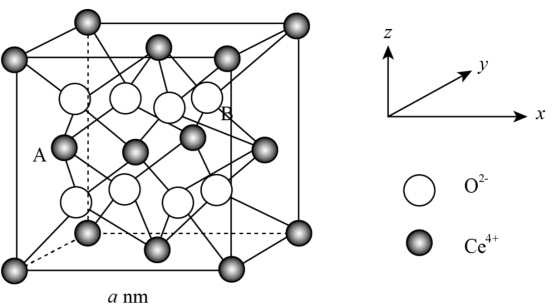
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0,
 ,
, ),则B离子的坐标为
),则B离子的坐标为③纳米CeO2中位于晶粒表面的Ce4+能发挥催化作用,在边长为2 a nm的立方体晶粒中位于表面的Ce4+最多有
您最近一年使用:0次
2022-05-27更新
|
4892次组卷
|
5卷引用:重庆市2021年高考真题化学试题
重庆市2021年高考真题化学试题四川省内江市第六中学2022-2023学年高二下学期期中考试化学试题(已下线)专题20 结构与性质(已下线)专题20 结构与性质宁夏回族自治区石嘴山市平罗中学2023-2024学年高三上学期第四次月考理科综合试题
2 . 2022年春晚中舞蹈诗剧《只此青绿》生动还原了北宋名画,《千里江山图》之所以色彩艳丽,璀璨夺目,与所使用矿物颜料有关。回答下列问题:
(1)石青,又名蓝矿石,化学式为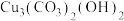 ,基态
,基态 核外电子的空间运动状态有
核外电子的空间运动状态有______ 种, 的空间构型为
的空间构型为________ 。原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则
表示,称为电子的自旋磁量子数,则 中电子自旋磁量子数的代数和为
中电子自旋磁量子数的代数和为________ 。
(2)亚铁氰化钾,化学式为 ,呈黄色结晶性粉末。
,呈黄色结晶性粉末。 中配体
中配体 的配位原子是
的配位原子是________ (填元素符号), 中C原子的杂化方式
中C原子的杂化方式_______ , 中σ键和π键的数目之比为
中σ键和π键的数目之比为________ 。
(3) 呈黑色或灰黑色,已知:晶胞中
呈黑色或灰黑色,已知:晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞的侧视图如图2所示。
所构成的四面体中心,晶胞的侧视图如图2所示。
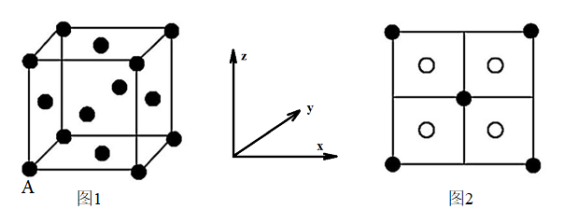
 填充了晶胞中四面体空隙的百分率是
填充了晶胞中四面体空隙的百分率是______ , 配位数为
配位数为________ 。已知图1中A原子的原子分数坐标为(0,0,0),则与A原子距离最近的 的原子分数坐标为
的原子分数坐标为________ 。若晶胞参数anm,晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为________ (用含a和d的式子表示)。
(1)石青,又名蓝矿石,化学式为
 ,基态
,基态 核外电子的空间运动状态有
核外电子的空间运动状态有 的空间构型为
的空间构型为 和
和 表示,称为电子的自旋磁量子数,则
表示,称为电子的自旋磁量子数,则 中电子自旋磁量子数的代数和为
中电子自旋磁量子数的代数和为(2)亚铁氰化钾,化学式为
 ,呈黄色结晶性粉末。
,呈黄色结晶性粉末。 中配体
中配体 的配位原子是
的配位原子是 中C原子的杂化方式
中C原子的杂化方式 中σ键和π键的数目之比为
中σ键和π键的数目之比为(3)
 呈黑色或灰黑色,已知:晶胞中
呈黑色或灰黑色,已知:晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞的侧视图如图2所示。
所构成的四面体中心,晶胞的侧视图如图2所示。
 填充了晶胞中四面体空隙的百分率是
填充了晶胞中四面体空隙的百分率是 配位数为
配位数为 的原子分数坐标为
的原子分数坐标为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
2022-03-06更新
|
1124次组卷
|
3卷引用:山东省日照市 2022届高三第一次模拟考试化学试题
山东省日照市 2022届高三第一次模拟考试化学试题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-测试福建省连城县第一中学2022-2023学年高三上学期第二次月考化学试题
名校
解题方法
3 . 关于物质结构与性质的内在联系,请回答下列问题:
(1)已知Se与O同族,基态Se原子价层电子的运动状态有______ 种,基态O原子的电子排布式不能表示为1s22s22p 2p
2p ,因为这违背了
,因为这违背了______ (填选项)。
A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2)已知液态的二氧化硫可以发生类似的水自身电离反应:2SO2(l) SO2++SO
SO2++SO 。SO2+中的σ键和π键数目之比为
。SO2+中的σ键和π键数目之比为______ ,SO2的空间构型为______ 。
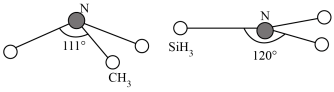
(3)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物结构和性质存在较大差异。化合物N(CH3)3(三角锥形)和N(SiH3)3(平面形)的结构如图所示,则二者中N的杂化方式分别为______ 。更易形成配合物的是______ 。______ 。______ g•cm-3(用含NA、a、b的式子表示)。
(1)已知Se与O同族,基态Se原子价层电子的运动状态有
 2p
2p ,因为这违背了
,因为这违背了A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2)已知液态的二氧化硫可以发生类似的水自身电离反应:2SO2(l)
 SO2++SO
SO2++SO 。SO2+中的σ键和π键数目之比为
。SO2+中的σ键和π键数目之比为(3)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物结构和性质存在较大差异。化合物N(CH3)3(三角锥形)和N(SiH3)3(平面形)的结构如图所示,则二者中N的杂化方式分别为
您最近一年使用:0次
名校
解题方法
4 . 主族元素N、F、Si、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于_______ 晶体;SiCl4中Si采取的杂化类型为_______ 。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点低于Cl2O,原因是_______ 。
(3)Se元素基态原子的原子核外电子排布式为_______ ;As的第一电离能比Se的第一电离能大的原因为_______ 。
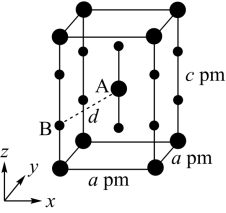
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ ;晶胞中A、B间距离d=_______ pm。
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于
(2)O、F、Cl电负性由大到小的顺序为
(3)Se元素基态原子的原子核外电子排布式为
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2022-05-02更新
|
860次组卷
|
7卷引用:陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题
陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
5 . 碳氮硫共脱除工艺可以协同除去工业废水中的S2-、NO 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
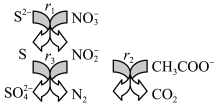
 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
| A.N2和CO2都是非极性分子 |
B.NO 和NO 和NO 的空间构型相同 的空间构型相同 |
C.NO 中存在离域π键 中存在离域π键 |
| D.冰醋酸中CH3COOH分子间存在范德华力和氢键 |
您最近一年使用:0次
2023-01-15更新
|
578次组卷
|
4卷引用:山东省潍坊市2022-2023学年高三上学期期末考试化学试题
名校
解题方法
6 . A~E是周期表中1~36号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多。
(1)基态B原子的价电子中,两种自旋状态的电子数之比为___________ 。 中C原子的杂化方式为
中C原子的杂化方式为___________ 。
(2)已知元素的电负性:C>D,则C与D形成的化合物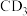 的空间构型为
的空间构型为___________ ,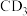 与水发生水解反应的化学方程式为
与水发生水解反应的化学方程式为___________ 。
(3)E位于元素周期表的___________ 区。
(4)已知常温下 的水解常数
的水解常数 。
。
常温下,含等物质的量浓度的HBC与NaBC的混合溶液显___________ (填“酸”“碱”或“中”)性,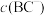
___________ (填“>”“<”或“=”)c(HBC)。常温下,若将 盐酸与
盐酸与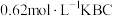 溶液等体积混合后恰好得到中性溶液,则c=
溶液等体积混合后恰好得到中性溶液,则c=___________ (小数点后保留4位数字)。
(1)基态B原子的价电子中,两种自旋状态的电子数之比为
 中C原子的杂化方式为
中C原子的杂化方式为(2)已知元素的电负性:C>D,则C与D形成的化合物
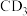 的空间构型为
的空间构型为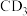 与水发生水解反应的化学方程式为
与水发生水解反应的化学方程式为(3)E位于元素周期表的
(4)已知常温下
 的水解常数
的水解常数 。
。常温下,含等物质的量浓度的HBC与NaBC的混合溶液显
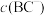
 盐酸与
盐酸与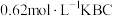 溶液等体积混合后恰好得到中性溶液,则c=
溶液等体积混合后恰好得到中性溶液,则c=
您最近一年使用:0次
2023-12-03更新
|
487次组卷
|
3卷引用:辽宁省沈阳市五校协作体2023-2024学年高二上学期期中考试化学试题
名校
解题方法
7 . 硼化物在生产、生活和科研中应用广泛。回答下列问题:
(1)立方氮化硼硬度大,熔点3000°C,其晶体类型为_______ 。制备氮化硼(BN)的一种方法为BCl3(g)+NH3(g)=BN(s)+3HCl(g)。BCl3的空间构型为_______ ,形成BCl3时,基态B原子价电子层上的电子先进行激发,再进行杂化,激发时B原子的价电子轨道表示式可能为_______ (填标号)。
A. B.
B.  C.
C. D.
D.
(2)硼砂阴离子[B4O5(OH)4]2-的球棍模型如图所示。其中B原子的杂化方式为_______ ,该阴离子中所存在的化学键类型有_______ (填标号)。

A.离子键 B.配位键 C.氢键 D.非极性共价键
(3)Ca与B组成的金属硼化物结构如图所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为_______ ,晶体中Ca原子的配位数为_______ ,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如M点原子的分数坐标为( ,
, ,
, ),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为
),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为 _______ ,Ca与 B 原子间的距离d=_______ pm(列出计算式即可)。

(1)立方氮化硼硬度大,熔点3000°C,其晶体类型为
A.
 B.
B.  C.
C. D.
D.
(2)硼砂阴离子[B4O5(OH)4]2-的球棍模型如图所示。其中B原子的杂化方式为

A.离子键 B.配位键 C.氢键 D.非极性共价键
(3)Ca与B组成的金属硼化物结构如图所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为
 ,
, ,
, ),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为
),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为 
您最近一年使用:0次
2022-01-13更新
|
1147次组卷
|
6卷引用:山东省济南市2021-2022学年上学期高三上学期1月学情检测化学试题
山东省济南市2021-2022学年上学期高三上学期1月学情检测化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)【直击双一流】03-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)山东省青岛第三十九中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
8 . 金属钛(Ti)及化合物在化工、医药、材料等领域具有广泛应用。回答下列问题:
(1)Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是___________ ,其电子占据最高能级的电子云轮廓图是___________
(2)K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是___________ ,它们的第二电离能(I2)分别为3051kJ/mol、1310kJ/mol,其原因是___________ 。
(3)钛与卤素形成的化合物TiX4熔点如下表
它们熔点差异的原因___________
(4)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为___________ ,与Ti形成配位键的元素是___________ ,碳碳键类型是___________ ;所含非金属元素的含氧酸根离子中心原子杂化轨道类型是sp2的是___________ 、立体构型是V形的是___________
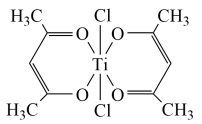
(5)已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=___________ g/cm3(阿伏加德罗常数值为NA,N、Ti的相对原子质量分别用Ar(N)和Ar(Ti)表示)

(1)Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是
(2)K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是
(3)钛与卤素形成的化合物TiX4熔点如下表
| TiX4 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点℃ | 377 | -24 | 38.3 | 153 |
(4)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为

(5)已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=

您最近一年使用:0次
2021-12-11更新
|
1036次组卷
|
6卷引用:四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题
四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)四川省达州市普通高中2022届高三第一次诊断性测试理综化学试题内蒙古自治区霍林郭勒市第一中学2022-203学年高三上学期9月月考化学试题宁夏银川市唐徕中学2022-2023学年高二下学期期中考试化学试题广东省韶关市武江区广东北江实验中学2021-2022学年高三下学期适应性考试(四)化学试题
解题方法
9 . 五氧化二钒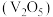 和三氧化钼
和三氧化钼 是两种重要的过渡金属氧化物,通常用作工业催化剂。有企业通过废旧催化剂(主要成分为
是两种重要的过渡金属氧化物,通常用作工业催化剂。有企业通过废旧催化剂(主要成分为 、
、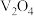 、
、 ,还有少量的
,还有少量的 、
、 、有机物等)来制备这两种氧化物。工艺流程图如下图:
、有机物等)来制备这两种氧化物。工艺流程图如下图:
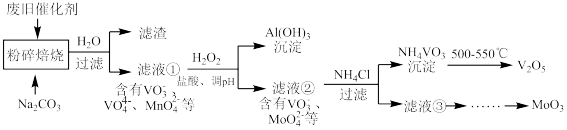
(1)“焙烧”的目的是_______ 。
(2)滤渣的主要成分是_______ (填化学式)。
(3)向滤液①中加 的作用是
的作用是_______ (用离子方程式表示)。
(4)当滤液①pH调控为8时,写出计算过程说明此时铝元素是否沉淀完全_______ 。(已知:
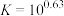 ,离子浓度小于
,离子浓度小于 认为沉淀完全)
认为沉淀完全)
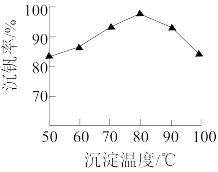
(5) 的沉淀过程中,沉钒率受温度影响,关系如图所示。温度高于80℃沉钒率降低的主要原因是
的沉淀过程中,沉钒率受温度影响,关系如图所示。温度高于80℃沉钒率降低的主要原因是_______ 。 的沉淀分解生成
的沉淀分解生成 的化学方程式是
的化学方程式是_______ 。
(6)仪器分析检测 在水中带有结晶水
在水中带有结晶水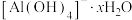 ,
, 与结晶水之间的作用力是_______(填字母)。
与结晶水之间的作用力是_______(填字母)。
(7)Mo原子序数42,气相单分子 空间结构是
空间结构是_______ 。
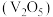 和三氧化钼
和三氧化钼 是两种重要的过渡金属氧化物,通常用作工业催化剂。有企业通过废旧催化剂(主要成分为
是两种重要的过渡金属氧化物,通常用作工业催化剂。有企业通过废旧催化剂(主要成分为 、
、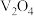 、
、 ,还有少量的
,还有少量的 、
、 、有机物等)来制备这两种氧化物。工艺流程图如下图:
、有机物等)来制备这两种氧化物。工艺流程图如下图:
(1)“焙烧”的目的是
(2)滤渣的主要成分是
(3)向滤液①中加
 的作用是
的作用是(4)当滤液①pH调控为8时,写出计算过程说明此时铝元素是否沉淀完全

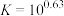 ,离子浓度小于
,离子浓度小于 认为沉淀完全)
认为沉淀完全)(5)
 的沉淀过程中,沉钒率受温度影响,关系如图所示。温度高于80℃沉钒率降低的主要原因是
的沉淀过程中,沉钒率受温度影响,关系如图所示。温度高于80℃沉钒率降低的主要原因是 的沉淀分解生成
的沉淀分解生成 的化学方程式是
的化学方程式是
(6)仪器分析检测
 在水中带有结晶水
在水中带有结晶水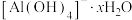 ,
, 与结晶水之间的作用力是_______(填字母)。
与结晶水之间的作用力是_______(填字母)。| A.离子键 | B.配位键 | C.氢键 | D.范德华力 |
 空间结构是
空间结构是
您最近一年使用:0次
名校
解题方法
10 . 砷化铝(AlAs)常用作光谱分析试剂和制备电子组件的原料,是一种新型半导体材料。回答下列问题:
(1)基态As原子的核外价电子排布图为_______ ;第一电离能I1(As)_______ I1(Se) (填“大于”或“小于”),其原因是_______ 。
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为_______ ;分子中As、S原子的杂化轨道类型分别为_______ 、_______ 。
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是_______ 、_______ 。
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为_______ ;该晶体密度为ρ g·cm-3,设NA为阿伏加德罗常数的值,晶胞参数为_______ pm。

(1)基态As原子的核外价电子排布图为
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为

您最近一年使用:0次



