名校
解题方法
1 . 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E正一价阳离子M能层电子已排满。D与B可形成离子化合物其晶胞结构如图所示。请回答下列问题:

(1)E元素原子基态时的价电子排布图为___________ ;
(2)A2F分子中F原子的杂化类型是_______ ,F的氧化物FO3分子空间构型为______ ;
(3)CA3极易溶于水,其原因主要是________ ,试判断CA3溶于水后形成CA3·H2O的合理结构________ (填字母代号),从氢键的形成角度回答推理依据是:___________ 。
(a) (b)
(b)
(4)E的晶胞常采取________ 堆积方式。
(5)从图中可以看出,D跟B形成的离子化合物的化学式为_________ ;该离子化合物晶体的密度为ag/cm3,则晶胞的体积是_______ cm3(写出表达式即可,NA表示阿伏加德罗常数的值)。

(1)E元素原子基态时的价电子排布图为
(2)A2F分子中F原子的杂化类型是
(3)CA3极易溶于水,其原因主要是
(a)
 (b)
(b)
(4)E的晶胞常采取
(5)从图中可以看出,D跟B形成的离子化合物的化学式为
您最近一年使用:0次
2017-05-10更新
|
125次组卷
|
2卷引用:辽宁省鞍山市第一中学2016-2017学年高二下学期期中考试化学试题2
名校
解题方法
2 . Fe、HCN与K2CO3在一定条件下发生如下反应:
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为___________________ 。
(2)配合物K4Fe(CN)6的中心离子是____________ ,该离子价电子的基态电子排布图为____________ 。
(3)lmol HCN分子中含有σ键的数目为____________ ,HCN分子中碳原子轨道杂化类型是____________ ,与CN-互为等电子体的阴离子是____________ 。
(4)K2CO3中阴离子的空间构型为____________ ,其中碳原子的价层电子对数为____________ 。
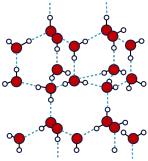
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有__________ 个氢键,若氢键键长为d nm,则晶体密度(g/cm3)计算式为____________ (用NA表示阿伏加德罗常数的值)。
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为
(2)配合物K4Fe(CN)6的中心离子是
(3)lmol HCN分子中含有σ键的数目为
(4)K2CO3中阴离子的空间构型为
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有

您最近一年使用:0次
2017-05-07更新
|
498次组卷
|
4卷引用:黑龙江省哈尔滨师范大学附属中学2017届高三第三次模拟考试化学试题
解题方法
3 . A 、B 、C 、D 、E是原子序数依次增加的短周期元素。
已知A是形成化合物种类最多的元素, B的第一电离能至第四电离能分别是932kJ·mol-1、1821kJ·mol-1、15390kJ·mol-1、21771kJ·mol-1;C元素原子核外最外层成对电子对数与其单电子数相等;D元素的常见单质的键能是双原子分子中最大的;E的氧化物是光电纤维的成分。F位于周期表中第四周期IIB族。回答下列问题:
(1)F元素原子的外围电子排布式____ .在F元素的硫酸盐中逐滴滴入NaOH溶液至过量得到透明澄清的无色溶液,该溶液中含有一种带两个单位负电荷的配离子,则F元素的硫酸盐与过量NaOH溶液反应的化学方程式为_____
(2)B与氯元素形成的化合物的立体构型为_____
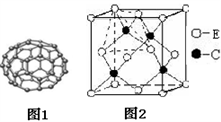
(3)C元素可形成多种单质。其中是一种单质的分子式为C60 则C60的为_____ 晶体,在该晶体中每个C原子只与相邻的3个C原子形成化学键,C60分子中只含有五边形和六边形。其结构如图1所示。则1molC60分子中含______ molσ键
(4)A、C 、D三元素形成的一种分子,其化学式为 A6C3D6,该分子结构与苯相似,其结构中含有三个-DA2,则A6C3D6的结构简式为_____ 。该分子中电负性最大的元素的杂化轨道类型是_____
(5)C与 E两元素空间网状结构的晶体。其晶胞如图2所示。查阅资料可知该晶体的熔点低于金刚石,其理由是____ ,若该晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为_______ (用含a.b.c的式子表示)。
已知A是形成化合物种类最多的元素, B的第一电离能至第四电离能分别是932kJ·mol-1、1821kJ·mol-1、15390kJ·mol-1、21771kJ·mol-1;C元素原子核外最外层成对电子对数与其单电子数相等;D元素的常见单质的键能是双原子分子中最大的;E的氧化物是光电纤维的成分。F位于周期表中第四周期IIB族。回答下列问题:

(1)F元素原子的外围电子排布式
(2)B与氯元素形成的化合物的立体构型为
(3)C元素可形成多种单质。其中是一种单质的分子式为C60 则C60的为
(4)A、C 、D三元素形成的一种分子,其化学式为 A6C3D6,该分子结构与苯相似,其结构中含有三个-DA2,则A6C3D6的结构简式为
(5)C与 E两元素空间网状结构的晶体。其晶胞如图2所示。查阅资料可知该晶体的熔点低于金刚石,其理由是
您最近一年使用:0次
解题方法
4 . [化学—选修3:物质结构与性质]
(1)已知X和Y均为短周期元素,其原子的第一至第五电离能如下表所示:
根据上述信息:
①X和氯元素形成的简单分子的空间构型为________ 。
②Y的基态原子的核外电子排布式为________ ,若Y和氯元素形成的分子的相对分子质量为267,请在下列方框中写出该分子的结构式(若存在配位键,用“→”表示)
_____
(2)碳元素可以形成多种单质及化合物:
①C60的结构如图1。C60中的碳原子的杂化轨道类型是________ ;

解释:②金刚石中的C-C的键长大于C60中C-C的键长的原因是________ ;
③金刚石的熔点高于C60的原因是________ ;
(3)如图2是钾的石墨插层化合物的晶胞图(图中大球表示K原子,小球表示C原子),如图3是晶胞沿右侧方向的投影.
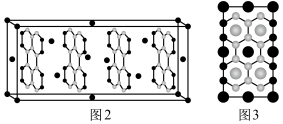
①该化合物的化学式是__________________ ;
②K层与C层之间的作用力是____________________________ ;
③K层中K原子之间的最近距离是C-C键的键长dC-C的_______________ 倍
(4)SiC的晶胞与金刚石的晶胞相似,设碳原子的直径为a cm,硅原子的直径为b cm,则晶胞的边长为_____________ cm(用含a、b的式子表示)。
(1)已知X和Y均为短周期元素,其原子的第一至第五电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 | I5 |
| X | 801 | 2427 | 3660 | 25026 | 32827 |
| Y | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
①X和氯元素形成的简单分子的空间构型为
②Y的基态原子的核外电子排布式为
(2)碳元素可以形成多种单质及化合物:
①C60的结构如图1。C60中的碳原子的杂化轨道类型是

| 碳元素单质 | C-C键长/pm | 熔点/℃ |
| 金刚石 | 154.45 | 3900 |
| C60 | 145~140 | 600(升华) |
③金刚石的熔点高于C60的原因是
(3)如图2是钾的石墨插层化合物的晶胞图(图中大球表示K原子,小球表示C原子),如图3是晶胞沿右侧方向的投影.

①该化合物的化学式是
②K层与C层之间的作用力是
③K层中K原子之间的最近距离是C-C键的键长dC-C的
(4)SiC的晶胞与金刚石的晶胞相似,设碳原子的直径为a cm,硅原子的直径为b cm,则晶胞的边长为
您最近一年使用:0次
11-12高二上·湖北黄冈·期中
解题方法
5 . 已知硼酸(分子式为H3BO3)对人体的受伤组织有缓和防腐作用,故可以用于医药和食品防腐等方面。试回答下列问题:
(1)已知硼酸分子中H只与O成键,则其分子结构式为____________ ,由其结构可推知硼酸应属于______ 酸(选填“弱”或“强”)。
(2)已知硼酸晶体呈片状,具有类似石墨那样的片层结构,片层之间作用较弱,有滑腻感,可做润滑剂。则层内H3BO3分子之间的作用力是________ ,层与层间的作用力是______ 。
(3)已知0.01mol硼酸可以被20mL 0.5mol·L-1NaOH溶液恰好完全中和,据此推知硼酸属____ 元酸。研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层有达到8电子稳定结构的趋向,如 。写出硼酸与NaOH溶液反应的离子方程式:
。写出硼酸与NaOH溶液反应的离子方程式:____________ 。
(1)已知硼酸分子中H只与O成键,则其分子结构式为
(2)已知硼酸晶体呈片状,具有类似石墨那样的片层结构,片层之间作用较弱,有滑腻感,可做润滑剂。则层内H3BO3分子之间的作用力是
(3)已知0.01mol硼酸可以被20mL 0.5mol·L-1NaOH溶液恰好完全中和,据此推知硼酸属
 。写出硼酸与NaOH溶液反应的离子方程式:
。写出硼酸与NaOH溶液反应的离子方程式:
您最近一年使用:0次
11-12高二上·湖北黄冈·期中
解题方法
6 . A、B、C、D、E为原子序数依次增大的短周期主族元素。已知A、B、C同周期,B、D同主族,且D的原子序数是B的2倍。回答下列问题:
(1)DC2分子的空间构型为___________ ,其中心原子采取_____ 杂化。
(2)DB2是________ (填“极性”或“非极性”)分子,其在水中的溶解度较大,其原因除了其分子的极性因素以外,另一原因是_____________________ 。
(3)若A是其所在周期元素中核外单电子数最多的元素,则+3价A的含氧酸、D及E的最高价含氧酸三者酸性由强到弱的顺序为_________________ (用酸的分子式作答);若A是所在周期原子半径最大的元素,则单质A与O2点燃的化学方程式为_________________ 。
(1)DC2分子的空间构型为
(2)DB2是
(3)若A是其所在周期元素中核外单电子数最多的元素,则+3价A的含氧酸、D及E的最高价含氧酸三者酸性由强到弱的顺序为
您最近一年使用:0次
9-10高二下·河南郑州·期末
解题方法
7 . H2O分子构型______ ,中心原子采取_____ 杂化,属于____ 分子(填极性或非极性)
SO3分子构型______ ,中心原子采取____ 杂化,属于_________ 分子(填极性或非极性)
HCN分子构型_______ ,中心原子采取____ 杂化,属于_________ 分子(填极性或非极性)
CH4构型________ ,中心原子采取____ 杂化,属于_________ 分子(填极性或非极性)
SO3分子构型
HCN分子构型
CH4构型
您最近一年使用:0次



