名校
解题方法
1 . W、R、X、Y、Z是原子序数依次增大的前四周期元素(只有Z是第四周期),其元素性质或原子结构如表:
回答下列问题:
(1)W、Y的最高价氧化物对应的水化物酸性更强的是___________ (填化学式)。
(2)W、R、X的简单氢化物中,三元素的原子的轨道杂化方式均为___________ ,键角由大到小的顺序是___________ (用对应的分子式表示),原因是___________ 。
(3)Z的价电子排布式为___________ ,Z位于元素周期表第___________ 族,属于___________ 区。
(4)R、X和Z元素的电负性由大到小的顺序是___________ (填元素符号)。
| 元素 | 元素性质或原子结构 |
| W | 基态原子L能层所有能级上电子数相同 |
| R | 第二周期元素基态原子中未成对电子最多 |
| X | 基态原子核外s能级上电子总数与p能级上电子总数相等,且第一电离能低于同周期相邻元素 |
| Y | 其价电子中,在不同形状的原子轨道中运动的电子数相等 |
| Z | 属于副族元素,且最外层只有1个电子,其他内层各能级所有轨道电子均成对 |
(1)W、Y的最高价氧化物对应的水化物酸性更强的是
(2)W、R、X的简单氢化物中,三元素的原子的轨道杂化方式均为
(3)Z的价电子排布式为
(4)R、X和Z元素的电负性由大到小的顺序是
您最近半年使用:0次
名校
解题方法
2 . 根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的立体构型正确的是
| 选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
| A |  | sp | 直线形 | 直线形 |
| B |  |  | 平面三角形 | 三角锥形 |
| C |  |  | 四面体形 | 平面三角形 |
| D |  |  | 四面体形 | 正四面体形 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024·福建·模拟预测
3 . 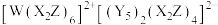 是合成某种全氮阴离子配合物所需的中间体。其中,X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素基态原子的电子只有一种自旋取向,Y与Z是同周期相邻非金属元素,且Y的第一电离能大于Z。下列说法正确的是
是合成某种全氮阴离子配合物所需的中间体。其中,X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素基态原子的电子只有一种自旋取向,Y与Z是同周期相邻非金属元素,且Y的第一电离能大于Z。下列说法正确的是
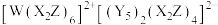 是合成某种全氮阴离子配合物所需的中间体。其中,X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素基态原子的电子只有一种自旋取向,Y与Z是同周期相邻非金属元素,且Y的第一电离能大于Z。下列说法正确的是
是合成某种全氮阴离子配合物所需的中间体。其中,X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素基态原子的电子只有一种自旋取向,Y与Z是同周期相邻非金属元素,且Y的第一电离能大于Z。下列说法正确的是| A.简单氢化物的沸点:Y>Z |
| B.简单离子的半径:W>Z>Y>X |
C.该中间体所含的大π键为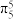 |
D. 分子的VSEPR模型名称为四面体 分子的VSEPR模型名称为四面体 |
您最近半年使用:0次
2024高三·全国·专题练习
解题方法
4 . 以镉铁矿(主要成分为CdO2)为原料制备Cd(BrO3)2的部分工艺流程如下:
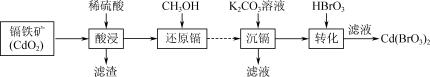
| A.已知Cd在周期表中位于第五周期IIB族,则Cd的价层电子排布式是4d105s2 |
| B.还原镉时可产生CO2,该反应中氧化剂与还原剂的物质的量之比为1∶3 |
C.“沉镉”所得滤液中的 ,其空间构型是正四面体形 ,其空间构型是正四面体形 |
| D.“转化”中发生的反应为CdCO3+2HBrO3=Cd(BrO3)2+CO2↑+H2O |
您最近半年使用:0次
名校
5 . 一定条件下, 、
、 都能与
都能与 形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。
形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 与
与 形成的水合物晶体俗称“可燃冰”。下列说法正确的是
形成的水合物晶体俗称“可燃冰”。下列说法正确的是
 、
、 都能与
都能与 形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。
形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 与
与 形成的水合物晶体俗称“可燃冰”。下列说法正确的是
形成的水合物晶体俗称“可燃冰”。下列说法正确的是
| A.水分子间存在氢键,故水分子高温下也很稳定 |
B. 的空间结构呈正四面体形, 的空间结构呈正四面体形, 、 、 空间结构呈V形 空间结构呈V形 |
C. 、 、 都是含极性键的非极性分子 都是含极性键的非极性分子 |
| D.可燃冰的笼状结构中甲烷分子与水分子形成共价键 |
您最近半年使用:0次
名校
6 . 下列化学用语表述正确的是
A. 的VSEPR模型为V形 的VSEPR模型为V形 | B.甲酸甲酯的结构简式: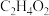 |
C. 分子的比例模型为 分子的比例模型为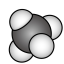 | D.羟基的电子式为: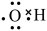 |
您最近半年使用:0次
解题方法
7 . 废定影液的主要成分为 ,以废定影液为原料制备
,以废定影液为原料制备 的工艺流程如图:
的工艺流程如图: )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
②常温下, 稳
稳 ;
; 。
。
(1)硫化钠溶液显碱性,其原因为___________ (用离子方程式表示)。
(2)比较S原子和O原子的电负性大小,并从原子结构的角度说明理由:___________ 。
(3) 的空间结构是
的空间结构是___________ 。
(4)常温下,“沉淀”时发生的反应为 ,平衡时,
,平衡时,
___________ (列出计算式即可)。
(5)“反应”时有淡黄色固体生成,发生反应的化学方程式为___________ 。
(6)MgS2O3·6H2O的晶胞形状为长方体,结构如图所示。 个数为
个数为___________ 。晶体中微粒间作用力有___________ (填标号)。
a.氢键 b.离子键 c.极性共价键 d.配位键
 ,以废定影液为原料制备
,以废定影液为原料制备 的工艺流程如图:
的工艺流程如图: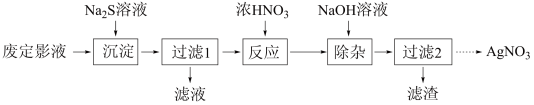
 )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。②常温下,
 稳
稳 ;
; 。
。(1)硫化钠溶液显碱性,其原因为
(2)比较S原子和O原子的电负性大小,并从原子结构的角度说明理由:
(3)
 的空间结构是
的空间结构是(4)常温下,“沉淀”时发生的反应为
 ,平衡时,
,平衡时,
(5)“反应”时有淡黄色固体生成,发生反应的化学方程式为
(6)MgS2O3·6H2O的晶胞形状为长方体,结构如图所示。
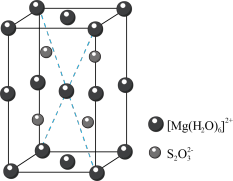
 个数为
个数为a.氢键 b.离子键 c.极性共价键 d.配位键
您最近半年使用:0次
解题方法
8 . 氮、磷、砷等元素的单质及化合物在生产、生活中应用广泛。回答下列问题:
(1)基态砷原子的价层电子的轨道表示式为__________________ 。
(2)基态氮原子核外电子占据的最高能级的原子轨道的形状为_____________ ;氮、磷、砷的简单氢化物 、
、 、
、 的空间结构均为
的空间结构均为__________ 形,键角由大到小的顺序为_________________ (填化学式),分析原因:____________________________ 。
(3) 与N—甲基咪唑(
与N—甲基咪唑( )反应可以得到
)反应可以得到 ,其结构如图所示。
,其结构如图所示。 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则N—甲基咪唑分子中的大
键的电子数,则N—甲基咪唑分子中的大 键可表示为
键可表示为___________ 。
(4)研究发现固态 和
和 均为离子晶体,但结构分别为
均为离子晶体,但结构分别为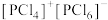 和
和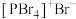 ,分析固态
,分析固态 和
和 结构存在差异的原因:
结构存在差异的原因:___________ 。
下列关于 、
、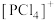 和[
和[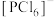 的结构的推断错误的是
的结构的推断错误的是___________ (填标号)。
A.气态 分子中P原子为
分子中P原子为 杂化
杂化
B.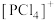 的空间结构为正四面体形
的空间结构为正四面体形
C.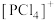 和
和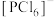 中P原子的杂化类型相同
中P原子的杂化类型相同
(1)基态砷原子的价层电子的轨道表示式为
(2)基态氮原子核外电子占据的最高能级的原子轨道的形状为
 、
、 、
、 的空间结构均为
的空间结构均为(3)
 与N—甲基咪唑(
与N—甲基咪唑( )反应可以得到
)反应可以得到 ,其结构如图所示。
,其结构如图所示。
 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则N—甲基咪唑分子中的大
键的电子数,则N—甲基咪唑分子中的大 键可表示为
键可表示为(4)研究发现固态
 和
和 均为离子晶体,但结构分别为
均为离子晶体,但结构分别为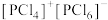 和
和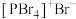 ,分析固态
,分析固态 和
和 结构存在差异的原因:
结构存在差异的原因:下列关于
 、
、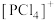 和[
和[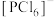 的结构的推断错误的是
的结构的推断错误的是A.气态
 分子中P原子为
分子中P原子为 杂化
杂化B.
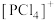 的空间结构为正四面体形
的空间结构为正四面体形C.
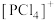 和
和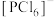 中P原子的杂化类型相同
中P原子的杂化类型相同
您最近半年使用:0次
2024高三·全国·专题练习
9 . 在硫酸铜溶液中加入过量浓氨水,可形成[Cu(NH3)4(H2O)2]2+。下列有关说法错误的是
| A.配离子中两种配体的中心原子杂化方式和VSEPR模型均相同 |
| B.基态原子第一电离能:N>O>S |
| C.键角:BF3>H2O>NH3 |
| D.1mol[Cu(NH3)4(H2O)2]2+中含22molσ键 |
您最近半年使用:0次
名校
10 . 下列化学用语表示正确的是
A.基态铜原子价电子的轨道表示式: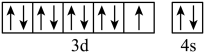 |
B.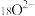 离子结构示意图: 离子结构示意图: |
C. 的空间结构: 的空间结构: (三角锥形) (三角锥形) |
D.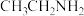 中氮原子为 中氮原子为 杂化 杂化 |
您最近半年使用:0次



