解题方法
1 . 第二周期元素其单质及化合物具有一些特殊的化学性质。回答下列问题。
(1)Li、Be、B三种元素第二电离能由大到小的顺序为_______ 。
(2)由于硼的氢化物与烷烃相似,故又称之为硼烷。乙硼烷( )的分子结构如图,该分子中B原子的杂化方式为
)的分子结构如图,该分子中B原子的杂化方式为_______ 。甲中化学键①为“二中心二电子键”,记作“2c-2e”,则乙硼烷的桥键②记作_______ 。氢原子仅用1s轨道就可形成桥键的原因为_______ 。_______ 。乙中由12个B与12个C构成的多面体含_______ 个棱。 溶解度(S=22g)大于
溶解度(S=22g)大于 (S=9.6g),从结构角度解释原因
(S=9.6g),从结构角度解释原因_______ 。
(1)Li、Be、B三种元素第二电离能由大到小的顺序为
(2)由于硼的氢化物与烷烃相似,故又称之为硼烷。乙硼烷(
 )的分子结构如图,该分子中B原子的杂化方式为
)的分子结构如图,该分子中B原子的杂化方式为
 溶解度(S=22g)大于
溶解度(S=22g)大于 (S=9.6g),从结构角度解释原因
(S=9.6g),从结构角度解释原因
您最近一年使用:0次
名校
解题方法
2 .  可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 。
。
回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,若在实验室进行“酸浸”,则不能使用玻璃仪器,原因是_______ 。
(2)滤渣1的主要成分是_______ (填化学式,下同),滤渣2的主要成分是_______ 。
(3)写出加入 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:_______ 。
(4)已知 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是_______ ,沉铈过程中会有一种气体产生,该气体是_______ (填化学式)。
(5) 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为_______ 。
(6)常温下, ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
_______  。
。
 可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: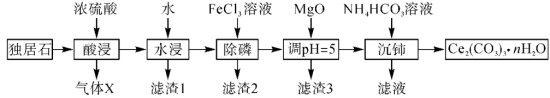
 。
。回答下列问题:
(1)
 的空间结构为
的空间结构为(2)滤渣1的主要成分是
(3)写出加入
 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:(4)已知
 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是(5)
 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为(6)常温下,
 ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
 。
。
您最近一年使用:0次
2024-03-03更新
|
152次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
解题方法
3 . W、X、Y、Z、R为原子序数依次增大的短周期主族元素,W的核外电子只有一种自旋方向;Y、Z、R在元素周期表中相邻,X的核外电子数与Y的价层电子数相等,R2是氧化性最强的单质,回答下列问题:
(1)由X原子核形成的三种微粒,电子排布式分别为:①1s22s2、②1s22s22p1、③1s22s12p2,有关这些微粒的叙述正确的是___________ (填标号)。
a.得电子能力:②>① b.表示基态原子(或离子)的是:①②
c.微粒半径:①>② d.电离一个电子所需最低能量:①>②>③
(2)YR3是一种重要的电子工业材料。分子的极性:YR3___________ XR3(填“>”或“<”或“=”);YR3与YW3结构相似,YW3易与过渡金属阳离子形成配离子而YR3不能,原因是___________ 。
(3)同周期元素中,第一电离能比Z大的元素有_________ 种;Z与Y形成的固态Y2Z5由YZ 和YZ
和YZ 两种离子组成,固态Y2Z5中Y原子的杂化方式为
两种离子组成,固态Y2Z5中Y原子的杂化方式为_________ ,YZ 的电子式为
的电子式为_________ 。
(4)X与Z可形成多种结构形式的阴离子,已知阴离子X3Z 结构中只有一个正六元环,则n=
结构中只有一个正六元环,则n=___________ ,该阴离子的结构式为___________ 。
(1)由X原子核形成的三种微粒,电子排布式分别为:①1s22s2、②1s22s22p1、③1s22s12p2,有关这些微粒的叙述正确的是
a.得电子能力:②>① b.表示基态原子(或离子)的是:①②
c.微粒半径:①>② d.电离一个电子所需最低能量:①>②>③
(2)YR3是一种重要的电子工业材料。分子的极性:YR3
(3)同周期元素中,第一电离能比Z大的元素有
 和YZ
和YZ 两种离子组成,固态Y2Z5中Y原子的杂化方式为
两种离子组成,固态Y2Z5中Y原子的杂化方式为 的电子式为
的电子式为(4)X与Z可形成多种结构形式的阴离子,已知阴离子X3Z
 结构中只有一个正六元环,则n=
结构中只有一个正六元环,则n=
您最近一年使用:0次
解题方法
4 . 第IIIA元素硼及其化合物在能源、材料、医药、环保等领域具有重要应用。回答下列问题:
(1)基态B原子价层电子的轨道表示式:___________ 。
(2)已知: 有空轨道,可以与
有空轨道,可以与 分子形成配位键,同时使原有的键削弱、断裂,从而发生水解。
分子形成配位键,同时使原有的键削弱、断裂,从而发生水解。
①下列卤化物不易发生水解的是___________ 。
A. B.
B. C.
C. D.
D.
②写出 水解的化学方程式
水解的化学方程式___________ 。
③写出 与NaOH溶液反应的离子方程式
与NaOH溶液反应的离子方程式___________ 。
(3)硼砂的阴离子的结构如图1,1mol该离子中有___________ 个硼氧四面体,含有配位键数目为___________ ,其中硼原子的杂化轨道类型为___________ 。

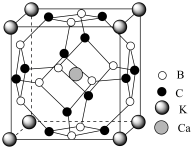
(4)硼化镁在39K温度下具有超导性,硼原子和镁原子分层排布,一层硼一层镁相间,部分原子沿垂直片层方向投影如图2,则硼化镁的化学式为___________ 。

(1)基态B原子价层电子的轨道表示式:
(2)已知:
 有空轨道,可以与
有空轨道,可以与 分子形成配位键,同时使原有的键削弱、断裂,从而发生水解。
分子形成配位键,同时使原有的键削弱、断裂,从而发生水解。①下列卤化物不易发生水解的是
A.
 B.
B. C.
C. D.
D.
②写出
 水解的化学方程式
水解的化学方程式③写出
 与NaOH溶液反应的离子方程式
与NaOH溶液反应的离子方程式(3)硼砂的阴离子的结构如图1,1mol该离子中有

(4)硼化镁在39K温度下具有超导性,硼原子和镁原子分层排布,一层硼一层镁相间,部分原子沿垂直片层方向投影如图2,则硼化镁的化学式为

您最近一年使用:0次
5 . 锂离子电池能够成为产业发展方向,主要基于其拥有较高的能量重量比和能量体积比等多项特性,正极材料为钴酸锂、锰酸锂和磷酸亚铁锂材料等。
(1)工业上用 、
、 、LiCl及苯胺(
、LiCl及苯胺( )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为_______ ,其在元素周期表中的位置为_______ ,O、N、P的电负性由大到小的顺序为_______ 。
(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。
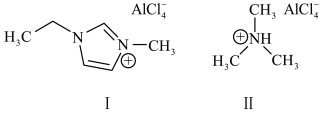
化合物Ⅰ中碳原子的杂化轨道类型为_______ ,1mol化合物Ⅰ中含有_______ 个σ键;化合物Ⅱ中阳离子的空间构型为_______ 。传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是_______ 。
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。
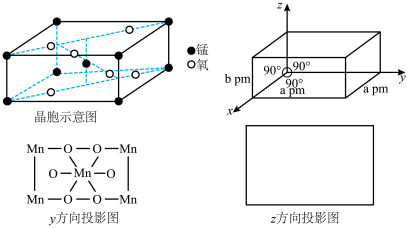
该锰的氧化物中Mn的化合价为_______ ,请画出z方向投影图_______ 。
(1)工业上用
 、
、 、LiCl及苯胺(
、LiCl及苯胺( )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。

化合物Ⅰ中碳原子的杂化轨道类型为
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。

该锰的氧化物中Mn的化合价为
您最近一年使用:0次
名校
解题方法
6 . 碳氮硫共脱除工艺可以协同除去工业废水中的S2-、NO 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
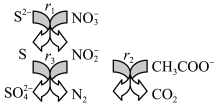
 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
| A.N2和CO2都是非极性分子 |
B.NO 和NO 和NO 的空间构型相同 的空间构型相同 |
C.NO 中存在离域π键 中存在离域π键 |
| D.冰醋酸中CH3COOH分子间存在范德华力和氢键 |
您最近一年使用:0次
2023-01-15更新
|
579次组卷
|
4卷引用:山东省潍坊市2022-2023学年高三上学期期末考试化学试题
解题方法
7 . 钛及其化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)Ti(BH4)3是一种储氢材料。BH 的空间构型为
的空间构型为_______ ;Ti 、B、H元素的电负性由大到小排列顺序为_______ 。
(2)已知Ti3+易形成多种配合物,[TiCl( H2O)5]Cl2· H2O是其中的一种。
①1 mol该配合物中含有_______ molσ键。
②中心离子杂化方式为_______ (填标号)。
a.sp2 b.sp3 c.sp3d d.sp3d2
③Ti3+具有较强还原性的原因是_______ 。
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-x Ny,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据_______ 个氧原子围成的八面体空隙。
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为( ,
, ,
, ),则A点原子的分数坐标为
),则A点原子的分数坐标为_______ ;晶胞中A、B间距离为_______ pm;TiO2晶体密度为_______ g·cm-3(设NA为阿伏加德罗常数的值)。
③TiO2-x Ny晶体中x=_______ 。
(1)Ti(BH4)3是一种储氢材料。BH
 的空间构型为
的空间构型为(2)已知Ti3+易形成多种配合物,[TiCl( H2O)5]Cl2· H2O是其中的一种。
①1 mol该配合物中含有
②中心离子杂化方式为
a.sp2 b.sp3 c.sp3d d.sp3d2
③Ti3+具有较强还原性的原因是
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-x Ny,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为(
 ,
, ,
, ),则A点原子的分数坐标为
),则A点原子的分数坐标为③TiO2-x Ny晶体中x=
您最近一年使用:0次
解题方法
8 . 硼单质及其化合物在生产生活中应用广泛。
(1)离子液体是指室温或接近室温时呈液态,而本身由阴、阳离子构成的化合物,被认为是21世纪理想的绿色溶剂。氯代 丁基
丁基 甲基咪唑离子液(
甲基咪唑离子液( )可以与
)可以与 发生离子交换反应合成离子液体
发生离子交换反应合成离子液体 ,如下图所示:
,如下图所示:

①第二周期中第一电离能介于B与N之间的元素为___________ (写元素符号); 中N原子的杂化方式为
中N原子的杂化方式为___________ , 的立体构型为
的立体构型为___________ 。
②已知分子或离子中的大 键可以用
键可以用 表示,其中m表示参与形成大
表示,其中m表示参与形成大 键的原子数,n表示大
键的原子数,n表示大 键中的电子数,则
键中的电子数,则 中的大
中的大 键可以表示为
键可以表示为___________ 。
(2)硼酸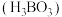 是极弱的一元酸,如图为
是极弱的一元酸,如图为 晶体的片层结构,同一层内硼酸分子间通过
晶体的片层结构,同一层内硼酸分子间通过___________ 相结合,层与层之间通过___________ 相结合。 在热水中比冷水中溶解度显著增大的主要原因是
在热水中比冷水中溶解度显著增大的主要原因是___________ 。

(3)一种新型轻质储氢材料的晶胞结构如图所示:

①该化合物的化学式为___________ 。
②设阿伏加德罗常数的值为 ,则晶胞的密度为
,则晶胞的密度为
___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)离子液体是指室温或接近室温时呈液态,而本身由阴、阳离子构成的化合物,被认为是21世纪理想的绿色溶剂。氯代
 丁基
丁基 甲基咪唑离子液(
甲基咪唑离子液( )可以与
)可以与 发生离子交换反应合成离子液体
发生离子交换反应合成离子液体 ,如下图所示:
,如下图所示:
①第二周期中第一电离能介于B与N之间的元素为
 中N原子的杂化方式为
中N原子的杂化方式为 的立体构型为
的立体构型为②已知分子或离子中的大
 键可以用
键可以用 表示,其中m表示参与形成大
表示,其中m表示参与形成大 键的原子数,n表示大
键的原子数,n表示大 键中的电子数,则
键中的电子数,则 中的大
中的大 键可以表示为
键可以表示为(2)硼酸
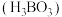 是极弱的一元酸,如图为
是极弱的一元酸,如图为 晶体的片层结构,同一层内硼酸分子间通过
晶体的片层结构,同一层内硼酸分子间通过 在热水中比冷水中溶解度显著增大的主要原因是
在热水中比冷水中溶解度显著增大的主要原因是
(3)一种新型轻质储氢材料的晶胞结构如图所示:

①该化合物的化学式为
②设阿伏加德罗常数的值为
 ,则晶胞的密度为
,则晶胞的密度为
 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2022-05-24更新
|
440次组卷
|
2卷引用:山东省潍坊市2022届高三下学期5月模拟考试(二)化学试题
解题方法
9 . 随着环境污染及能源短缺的日益严重,汽车行业掀起了电动车热潮。2020年全球新能源汽车领导者比亚迪推出了“刀片电池”,大幅度提高了续航里程。刀片电池称为超级磷酸铁锂电池,其正极材料为 ,总反应式为:
,总反应式为: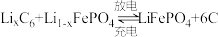 。回答下列问题:
。回答下列问题:
(1)Fe在元素周期表中的位置为___________ 。基态 比
比 结构稳定的原因可解释为
结构稳定的原因可解释为___________ 。
(2) 中Fe的化合价为
中Fe的化合价为___________ ,其离子常用___________ 试剂检验, 的空间构型为
的空间构型为___________ 。
(3)电池负极为嵌入Li的石墨烯层,其晶胞结构如下图。

①石墨烯是由碳原子形成的六元环状二维空间结构,其中C原子的杂化方式为___________ 。
②设 为阿伏加德罗常数的数值,该晶胞密度为
为阿伏加德罗常数的数值,该晶胞密度为___________  (列出计算式即可)。
(列出计算式即可)。
 ,总反应式为:
,总反应式为: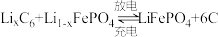 。回答下列问题:
。回答下列问题:(1)Fe在元素周期表中的位置为
 比
比 结构稳定的原因可解释为
结构稳定的原因可解释为(2)
 中Fe的化合价为
中Fe的化合价为 的空间构型为
的空间构型为(3)电池负极为嵌入Li的石墨烯层,其晶胞结构如下图。

①石墨烯是由碳原子形成的六元环状二维空间结构,其中C原子的杂化方式为
②设
 为阿伏加德罗常数的数值,该晶胞密度为
为阿伏加德罗常数的数值,该晶胞密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
10 . 2022年春晚节目《只此青绿》取材于宋代名画《千里江山图》,该画描绘了山清水秀的美丽景色,历经千年色彩依然,其中青色来自蓝铜矿颜料[主要成分为Cu3(CO3)2(OH)2]。请回答下列问题:
(1)基态铜原子价电子排布式为_______ 。从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)_______ I2(Cu) (填“>”“<”或“=”),并解释有关原因_______ 。
(2) 的空间构型为
的空间构型为_______ 。
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是_______ (填元素符号),该配合物中采用sp2杂化的碳原子与sp3杂化的碳原子个数比为_______ 。
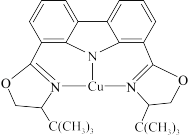
(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。
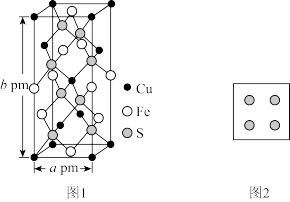
①Fe3+周围距离最近的S2-的个数为_______ 。
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为_______ mol-1(用a、b、ρ表示,并化成最简)。
(1)基态铜原子价电子排布式为
(2)
 的空间构型为
的空间构型为(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是

(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。

①Fe3+周围距离最近的S2-的个数为
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为
您最近一年使用:0次
2022-05-04更新
|
736次组卷
|
4卷引用:山东省菏泽市单县第二中学2021-2022学年高二下学期慧光班段考化学试题
山东省菏泽市单县第二中学2021-2022学年高二下学期慧光班段考化学试题安徽省淮北市2022届高三第二次模拟考试理科综合化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)四川省南充高级中学2021-2022学年高二下学期期中考试化学试题



