名校
解题方法
1 . 下列叙述中正确的是
A. 为角形的极性分子,形成分子晶体 为角形的极性分子,形成分子晶体 |
B. 的空间结构为平面三角形 的空间结构为平面三角形 |
C.氯化硼 的熔点为 的熔点为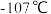 ,氯化硼液态时能导电而固态时不导电 ,氯化硼液态时能导电而固态时不导电 |
D.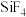 和 和 的中心原子均为 的中心原子均为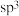 杂化, 杂化, 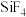 分子呈正四面体形, 分子呈正四面体形, 呈三角锥形 呈三角锥形 |
您最近一年使用:0次
2021-02-07更新
|
1381次组卷
|
14卷引用:山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题
山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题黑龙江省龙东南联合体2018-2019学年高二下学期期末考试化学试题宁夏海原县第一中学2019-2020学年高二下学期期末考试化学试题新疆生产建设兵团第三师图木舒克市第一中学2022-2023学年高二下学期期末考试化学试题广西壮族自治区南宁市第二中学2022-2023学年高二下学期期末化学考试试卷(已下线)第35讲 分子结构与性质-2021年高考化学一轮复习名师精讲练(人教版2019)选择性必修2 阶段性综合评估测试卷(二)鲁科版2019选择性必修2阶段性综合评估测试卷(二)广东省佛山市南海区南海中学2021-2022学年高二年级下学期4月月考化学试题湖北省襄阳市第一中学2022-2023学年高二下学期3月月考化学试题四川省广安市第二中学校2022-2023学年高二下学期期中考试化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次阶段考试化学试题四川省泸县第五中学2022-2023学年高二下学期5月期中考试化学试题河北省邯郸市磁县第一中学2023-2024学年高二上学期七调月考化学试题
2 . EDTA(乙二胺四乙酸)是一种重要的络合剂,结构简式如图所示。关于化合物[Cu(EDTA)]SO4的说法正确的是
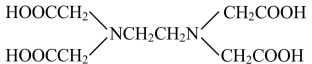
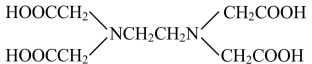
A.SO 与PO 与PO 互为等电子体,空间构型均为正四面体 互为等电子体,空间构型均为正四面体 |
| B.EDTA中碳原子的杂化轨道类型为sp、sp2、sp3 |
| C.EDTA组成元素的第一电离能顺序为O>N>C>H |
| D.[Cu(EDTA)]SO4中所含的化学键有离子键、共价键、配位键和氢键 |
您最近一年使用:0次
2021-01-24更新
|
410次组卷
|
7卷引用:山西省长治市第二中学校2020-2021学年高二上学期期末考试化学试题
山西省长治市第二中学校2020-2021学年高二上学期期末考试化学试题(已下线)2.2 分子的空间结构(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)辽宁省大连市第一中学 2021-2022学年高三上学期期中联考化学试题湖北省重点中学沃学联盟2021-2022学年高三上学期期中联考化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)湖北省蕲春县第一高级中学2022届高三5月第三次模拟考试化学试题辽宁省大连市普兰店区第一中学2022届高三上学期期中联考化学试题
名校
3 . 氮、磷是植物生长所需的重要元素,回答下列问题
(1)下列N原子电子排布图表示的状态中,能量由低到高的顺序是__________
A. B.
B.
C. D.
D.
(2)羟胺(NH2OH)可看成是氨分子内的一个氢原子被羟基取代的衍生物,分子中N的杂化类型是__________ ,羟胺易溶于水,其主要原因是__________ 。
(3)磷酸属于中强酸,其结构式为 ,磷酸分子之间可以通过羟基间脱水形成多磷酸,如二聚磷酸
,磷酸分子之间可以通过羟基间脱水形成多磷酸,如二聚磷酸 ,写出多磷酸的通式
,写出多磷酸的通式__________ ,含有25个磷原子的多磷酸分子中,σ键与π键的数目分别为__________ 、__________
(4)N和Cl只能形成NCl3,而P和Cl除能形成PCl3外,还能形成PCl5,原因为__________ 。
(1)下列N原子电子排布图表示的状态中,能量由低到高的顺序是
A.
 B.
B.
C.
 D.
D.
(2)羟胺(NH2OH)可看成是氨分子内的一个氢原子被羟基取代的衍生物,分子中N的杂化类型是
(3)磷酸属于中强酸,其结构式为
 ,磷酸分子之间可以通过羟基间脱水形成多磷酸,如二聚磷酸
,磷酸分子之间可以通过羟基间脱水形成多磷酸,如二聚磷酸 ,写出多磷酸的通式
,写出多磷酸的通式(4)N和Cl只能形成NCl3,而P和Cl除能形成PCl3外,还能形成PCl5,原因为
您最近一年使用:0次
名校
解题方法
4 . 下列关于物质结构的命题中,错误的项数有( )
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于p区
③非极性分子往往具有高度对称性,如BF3、PCl5、H2O2、CO2这样的分子
④Na2O、Na2O2、NaHSO4晶体中的阴、阳离子个数比均为1 :2
⑤Cu(OH)2是一种蓝色絮状沉淀,既能溶于硝酸、也能溶于氨水,是两性氢氧化物
⑥氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为: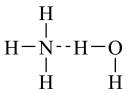
⑦HF沸点高于HCl,是因为 HCl共价键键能小于HF
⑧可燃冰中甲烷分子与水分子之间存在氢键
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于p区
③非极性分子往往具有高度对称性,如BF3、PCl5、H2O2、CO2这样的分子
④Na2O、Na2O2、NaHSO4晶体中的阴、阳离子个数比均为1 :2
⑤Cu(OH)2是一种蓝色絮状沉淀,既能溶于硝酸、也能溶于氨水,是两性氢氧化物
⑥氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为:

⑦HF沸点高于HCl,是因为 HCl共价键键能小于HF
⑧可燃冰中甲烷分子与水分子之间存在氢键
| A.4项 | B.5项 | C.6项 | D.7项 |
您最近一年使用:0次
2020-07-16更新
|
2739次组卷
|
9卷引用:山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题
山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题山西省太原市山西大学附属中学2019-2020学年高二下学期5月化学试题山东省潍坊市诸城一中2021届高三11月份模拟化学试题辽宁省东北育才学校2021-2022学年高三上学期( 高中部) 第三次模拟考试化学试题辽宁省沈阳市东北育才学校科学高中2021-2022学年高二下学期线上4月测试化学试题专题4 分子空间结构与物质性质 本专题达标检测天津北京师范大学静海附属学校2021-2022学年高二下学期期中考试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破天津市五校2023届高三一模联考化学试题
真题
名校
5 . 氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_______ 。
a.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
b.Ca2+与F-间仅存在静电吸引作用
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是__________________________ (用离子方程式表示)。 已知AlF63-在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为___________ ,其中氧原子的杂化方式为_________ 。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键键能为159kJ·mol-1,Cl-Cl键键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为_________ kJ·mol-1。ClF3的熔、沸点比BrF3的________ (填“高”或“低”)。
(1)下列关于CaF2的表述正确的是
a.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
b.Ca2+与F-间仅存在静电吸引作用
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键键能为159kJ·mol-1,Cl-Cl键键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为
您最近一年使用:0次
2016-12-09更新
|
1638次组卷
|
10卷引用:山西省原平市范亭中学2016-2017学年高二下学期期末考试化学试题
山西省原平市范亭中学2016-2017学年高二下学期期末考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题2015年全国普通高等学校招生统一考试化学(山东卷)河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题(已下线)二轮复习 专题17 物质结构与性质 押题专练河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:3.4 离子晶体吉林省长春市东北师大附中2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题福建省莆田第一中学2019-2020学年高二下学期期中考试化学试题四川省巴中市平昌县驷马中学2020-2021学年高二上学期 十一月月考化学试题
名校
6 . 由短周期前10号元素组成的物质T和X,存在如图所示的转化关系。X不确定,易分解。下列有关说法正确的是


| A.为使该转化成功进行,Y可以是酸性KMnO4溶液 |
| B.等物质的量的T、X分子中含有π键的数目均为NA |
C.T、X分子中的 原子分别采用sp2杂化和sp3杂化 原子分别采用sp2杂化和sp3杂化 |
| D.T分子中只含有极性键,X分子中既含有极性键又含有非极性键 |
您最近一年使用:0次
2016-08-11更新
|
398次组卷
|
4卷引用:2015-2016学年山西省临汾一中高二下期末化学试卷
2015-2016学年山西省临汾一中高二下期末化学试卷吉林省延边第二中学2018-2019学年高二下学期期末考试化学试题安徽省霍邱县第二中学2019-2020学年高二下学期段考化学试题(已下线)第二单元 化学键与分子间作用力(能力提升卷)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)



