解题方法
1 . 历史上金、银、铜主要是作为货币金属或装饰品被应用。试回答下列问题:
(1)Ag在元素周期表中的位置_________ ,Ag+的价电子排布式为_________ 。
(2)冶金工业上,提取金的原理是2[Au(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有________ (任写一种),HCN分子中σ键和π键数目之比为_________ 。
(3)已知基态铜的部分电离能如表所示:
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是_________ 。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到结构如图所示配合物。

①配合物中碳原子的轨道杂化类型为_________ 。
②1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为_________ mol。
(5)某Q原子的外围电子排布式为3s23p5,铜与Q形成化合物的晶胞如图所示(白球代表Q原子)。每个铜原子周围距离最近的铜原子数目为_________ 个;该晶体的化学式为_________ 。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏加 德罗常数的值为NA,则该晶体中铜原子和Q原子之间的最短距离为_________ pm(1pm=10-12m,只写计算式)。

(1)Ag在元素周期表中的位置
(2)冶金工业上,提取金的原理是2[Au(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有
(3)已知基态铜的部分电离能如表所示:
| 电离能/kJ/mol | I1 | I2 | I3 |
| Cu | 746 | 1958 | 2058 |
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到结构如图所示配合物。

①配合物中碳原子的轨道杂化类型为
②1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为
(5)某Q原子的外围电子排布式为3s23p5,铜与Q形成化合物的晶胞如图所示(白球代表Q原子)。每个铜原子周围距离最近的铜原子数目为

您最近一年使用:0次
2020-07-07更新
|
211次组卷
|
2卷引用:西藏昌都市第一高级中学2021届高三上学期期末考试理综化学试题
2 . A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是_____________ 。
(2)B、C、D元素的第一电离能由大到小的顺序是_________________ 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是___________ ;B、C的这些氢化物的沸点相差较大的主要原因是______________ 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是_____________ ;1 mol该分子中含有π键的数目是___________ 。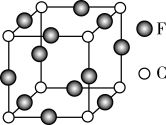
(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是_______________ ,C原子的配位数是______________ 。
(1)E+离子的电子排布式是
(2)B、C、D元素的第一电离能由大到小的顺序是
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是

(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是
您最近一年使用:0次
2017-02-17更新
|
490次组卷
|
2卷引用:2017届西藏拉萨中学高三上期末理综化学卷
11-12高二上·湖北黄冈·期末
名校
解题方法
3 . 下列分子中心原子是sp2杂化的是( )
| A.PBr3 | B.CH4 | C.BF3 | D.H2O |
您最近一年使用:0次
2016-12-09更新
|
767次组卷
|
8卷引用:西藏拉萨市八校2018-2019学年高二下学期期末联考化学试题



