名校
解题方法
1 . 物质的结构决定其性质,下列实例与解释不 相符的是
| 选项 | 实例 | 解释 |
| A | 邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点 | 分子间氢键使熔沸点升高,分子内氢键使熔沸点降低 |
| B |  与 与 形成配合物 形成配合物 |  中的 中的 有空轨道,可接受 有空轨道,可接受 中 中 的孤电子对 的孤电子对 |
| C |  的沸点高于 的沸点高于 |  原子半径小, 原子半径小, 键能大 键能大 |
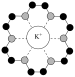
| D | 超分子冠醚(18-冠-6)如图所示,其空穴与 尺寸适配 尺寸适配
| 两者能通过弱相互作用(非化学键)形成超分子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 晶体世界丰富多彩、复杂多样,各类晶体具有的不同结构特点,决定着它们具有不同的性质和用途。氢化铝钠 是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为
是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为 下列说法错误的是
下列说法错误的是
 是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为
是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为 下列说法错误的是
下列说法错误的是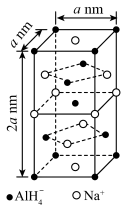
A. 中中心原子 中中心原子 的杂化方式为 的杂化方式为 杂化 杂化 |
B. 晶体中,与 晶体中,与 紧邻且等距的 紧邻且等距的 有4个 有4个 |
C. 晶体的密度为 晶体的密度为 |
D.若 晶胞上下面心处的 晶胞上下面心处的 被 被 取代,得到的晶体的化学式为 取代,得到的晶体的化学式为 |
您最近一年使用:0次
2024-05-30更新
|
225次组卷
|
2卷引用:河北省保定市九校2024届高三下学期二模化学试题
名校
解题方法
3 . 韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法正确的是
| A.暖冰中水分子对称性由C2轴变为C∞ |
| B.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
| C.暖冰中水分子的氧原子的杂化方式为sp3,氢键键能可达到250kJ/mol |
| D.水凝固形成20℃时的“暖冰”氢键键长有变化 |
您最近一年使用:0次
名校
4 . 化合物 是良好的电和热绝缘体,组成元素原子序数均小于20,且在前四个周期均有分布。仅X和M同族,电负性:
是良好的电和热绝缘体,组成元素原子序数均小于20,且在前四个周期均有分布。仅X和M同族,电负性: ;Y和Z同周期,Y的基态原子价层电子排布式为
;Y和Z同周期,Y的基态原子价层电子排布式为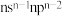 ,Z的基态原子价层的s和p轨道电子数相同;E在地壳中含量最多。下列说法正确的是
,Z的基态原子价层的s和p轨道电子数相同;E在地壳中含量最多。下列说法正确的是
 是良好的电和热绝缘体,组成元素原子序数均小于20,且在前四个周期均有分布。仅X和M同族,电负性:
是良好的电和热绝缘体,组成元素原子序数均小于20,且在前四个周期均有分布。仅X和M同族,电负性: ;Y和Z同周期,Y的基态原子价层电子排布式为
;Y和Z同周期,Y的基态原子价层电子排布式为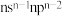 ,Z的基态原子价层的s和p轨道电子数相同;E在地壳中含量最多。下列说法正确的是
,Z的基态原子价层的s和p轨道电子数相同;E在地壳中含量最多。下列说法正确的是A.原子半径: | B.第一电离能: |
C.熔点: | D. 中的E的杂化方式: 中的E的杂化方式: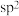 |
您最近一年使用:0次
2024-03-15更新
|
657次组卷
|
2卷引用:广东省江门市2023-2024学年高三一模考试化学卷
5 . 胆矾CuSO4·5H2O可写[Cu(H2O)]SO4·H2O,其结构示意图如下:
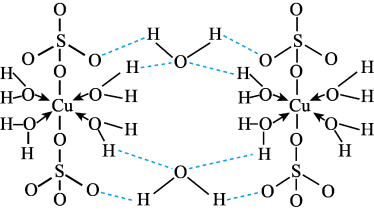
下列有关胆矾的说法正确的是

下列有关胆矾的说法正确的是
| A.Cu2+的价电子排布式为3d84s1 |
| B.所有氧原子都采取sp3杂化 |
| C.氧原子参与形成离子键、配位键、σ键和氢键四种化学键 |
| D.第二周期的元素中第一电离能比氧原子大的元素有三种 |
您最近一年使用:0次
6 . 以下哪个说法是正确的
| A.同核双原子分子的分子轨道,如果对于分子中心反对称,那么是反键轨道 |
| B.杂化轨道是体系几何构型的反映,它不是真实存在的 |
| C.分子的几何构型可通过计算中心原子的价层电子对数来判断 |
D.根据电子云的重叠形式可以把共价键分成 和 和 成键形式 成键形式 |
您最近一年使用:0次
解题方法
7 . Na2B4O7·10H2O俗称硼砂,其结构如下图所示。下列说法错误的是
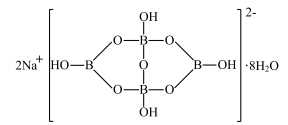

| A.B和O原子的杂化方式完全相同 | B.阴离子中存在配位键 |
| C.第一电离能:Na<B<O | D.硼砂的水溶液显碱性 |
您最近一年使用:0次
2023-02-03更新
|
1528次组卷
|
3卷引用:湖北省高中名校联盟2022-2023学年高三第三次联合测评化学试题
湖北省高中名校联盟2022-2023学年高三第三次联合测评化学试题(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)湖北省高中名校联盟2022-2023学年高三下学期第三次联合测评化学试题
解题方法
8 . 共价有机框架( )是一类具有平面、多孔网状结构的材料,其在催化、能量储存等领域有潜在的应用。一种
)是一类具有平面、多孔网状结构的材料,其在催化、能量储存等领域有潜在的应用。一种 材料的合成如图所示。(图中
材料的合成如图所示。(图中 表示链延长)。
表示链延长)。
已知: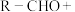 R′-CH2CN
R′-CH2CN
 +H2O
+H2O

下列说法正确的是
 )是一类具有平面、多孔网状结构的材料,其在催化、能量储存等领域有潜在的应用。一种
)是一类具有平面、多孔网状结构的材料,其在催化、能量储存等领域有潜在的应用。一种 材料的合成如图所示。(图中
材料的合成如图所示。(图中 表示链延长)。
表示链延长)。已知:
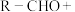 R′-CH2CN
R′-CH2CN
 +H2O
+H2O
下列说法正确的是
A. 分子中碳原子有两种杂化方式 分子中碳原子有两种杂化方式 |
B. 的核磁共振氢谱有4组峰 的核磁共振氢谱有4组峰 |
C.合成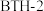 的过程中发生了取代反应 的过程中发生了取代反应 |
D.乙二醛也可与 合成 合成 材料 材料 |
您最近一年使用:0次
解题方法
9 . 苯虽然可以发生各种化学反应,但苯环却通常难以被打破。2019年,英国牛津大学的研究人员却发现,一种基于铝的配位化合物能够将靠转换成直键烃类,反应如下:
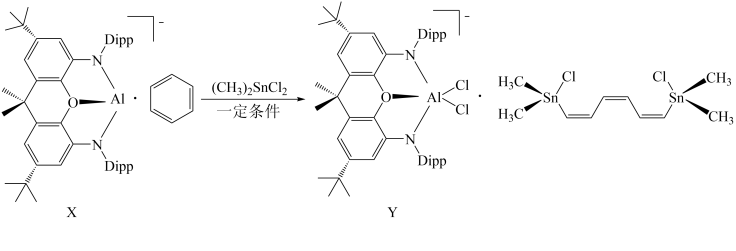
其中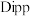 为邻苯二甲酸异戊酯。下列说法正确的是
为邻苯二甲酸异戊酯。下列说法正确的是

其中
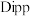 为邻苯二甲酸异戊酯。下列说法正确的是
为邻苯二甲酸异戊酯。下列说法正确的是A. 有 有 和 和 两种同分异构体 两种同分异构体 |
| B.由于苯可以从石油中获取,这一发现有望拓展石油化工的产品范围 |
C.Y中 的氧化数为 的氧化数为 |
D.化合物X中的氧原子采取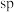 杂化成键 杂化成键 |
您最近一年使用:0次
名校
解题方法
10 . 一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素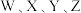 的原子序数依次增大、且总和为24.下列有关叙述错误的是
的原子序数依次增大、且总和为24.下列有关叙述错误的是

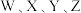 的原子序数依次增大、且总和为24.下列有关叙述错误的是
的原子序数依次增大、且总和为24.下列有关叙述错误的是
A.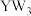 分子中Y原子采用 分子中Y原子采用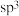 杂化 杂化 |
B.简单离子半径: |
C. 中并非所有原子均为8电子稳定结构 中并非所有原子均为8电子稳定结构 |
D.第二周期中,第一电离能介于 元素之间的元素共有2种 元素之间的元素共有2种 |
您最近一年使用:0次
2020-12-15更新
|
3382次组卷
|
8卷引用:天津市第一中学2021届高三上学期第二次月考化学试题