22-23高二下·上海浦东新·期末
名校
解题方法
1 . 酸雨的危害非常严重,它会导致生物死亡,古建筑被腐蚀和破坏,现代钢铁建筑很快锈蚀,土壤酸化,作物难以生长,严格控制酸性气体的排放意义重大。
(1)臭氧 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 、
、 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。 的空间构型为
的空间构型为___________ , 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ 。
(2) 基态核外电子排布式为
基态核外电子排布式为___________ 。
(3) 能被
能被 溶液吸收生成配含物
溶液吸收生成配含物 ,其中心离子的配位数为
,其中心离子的配位数为_______ 。
(4) 以N原子与
以N原子与 形成配位键。请在
形成配位键。请在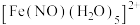 结构示意图的相应位置补填缺少的配体
结构示意图的相应位置补填缺少的配体_________ 。
(1)臭氧
 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 、
、 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。 的空间构型为
的空间构型为 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为(2)
 基态核外电子排布式为
基态核外电子排布式为(3)
 能被
能被 溶液吸收生成配含物
溶液吸收生成配含物 ,其中心离子的配位数为
,其中心离子的配位数为(4)
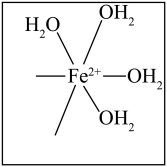
 以N原子与
以N原子与 形成配位键。请在
形成配位键。请在 结构示意图的相应位置补填缺少的配体
结构示意图的相应位置补填缺少的配体
您最近一年使用:0次
2 . 锌是生命中不可或缺的微量元素,有“生命火花”之称。硫酸锌常用作动植物补锌试剂,工业上,硫酸锌可由菱锌矿制备,菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如图:

本题中所涉及离子的氢氧化物溶度积常数如表:
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为_______ 。
(2)为了提高锌的浸取效果,可采取的措施有_______ 、_______ 。
(3)加入物质X调节溶液pH=5,以下试剂能实现该目的是_______ 。
A.NH3•H2O B.Ca(OH)2 C.NaOH D.MgO
滤渣①的主要成分是_______ 。
(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该反应的离子方程式为_______ 。
(5)滤液②中加入锌粉的目的是_______ 。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是_______ 。
(7)硫酸锌溶液与过量氨水反应可生成配离子[Zn(NH3)4]2+,其结构如图所示:

①请在结构图中用箭头标出配位键_______ 。
②该配离子所含配体的分子空间构型为_______ 。

本题中所涉及离子的氢氧化物溶度积常数如表:
| 离子 | Fe3+ | Zn2+ | Cu2+ | Fe2+ | Mg2+ |
| Ksp | 4.0×10-38 | 6.7×10-17 | 2.2×10-20 | 8.0×10-16 | 1.8×10-11 |
(1)菱锌矿焙烧生成氧化锌的化学方程式为
(2)为了提高锌的浸取效果,可采取的措施有
(3)加入物质X调节溶液pH=5,以下试剂能实现该目的是
A.NH3•H2O B.Ca(OH)2 C.NaOH D.MgO
滤渣①的主要成分是
(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该反应的离子方程式为
(5)滤液②中加入锌粉的目的是
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是
(7)硫酸锌溶液与过量氨水反应可生成配离子[Zn(NH3)4]2+,其结构如图所示:

①请在结构图中用箭头标出配位键
②该配离子所含配体的分子空间构型为
您最近一年使用:0次
名校
解题方法
3 . 羰基铁[Fe(CO)5]广泛用于催化剂,汽油抗爆剂等,为黄色粘稠状液体,熔点为-20℃,沸点为103℃,60℃在空气中可自燃,其结构和部分键长如图所示。
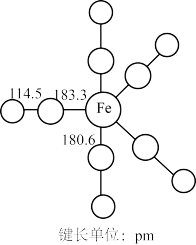
(1)Fe(CO)5晶体类型为___________ 。(填“离子晶体”或“分子晶体”)
(2)下列说法正确的是___________。

(1)Fe(CO)5晶体类型为
(2)下列说法正确的是___________。
| A.中心Fe原子可能采取sp3杂化 | B.配体与Fe原子所形成的配位键的键能相同 |
| C.Fe在周期表中位于Ⅷ族,属于d区元素 | D.制备Fe(CO)5应在隔绝空气的条件下进行 |
您最近一年使用:0次
4 . 在CuSO4·5H2O晶体中( )
| A.存在水分子 | B.没有共价键 | C.只有离子键 | D.含有金属键 |
您最近一年使用:0次



