名校
1 . 羰基铁[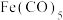 ]广泛用于催化剂,汽油抗爆剂等,为黄色粘稠状液体,熔点为
]广泛用于催化剂,汽油抗爆剂等,为黄色粘稠状液体,熔点为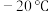 ,沸点为103℃,60℃在空气中可自燃,其结构和部分键长如图所示。
,沸点为103℃,60℃在空气中可自燃,其结构和部分键长如图所示。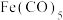 晶体类型为___________。
晶体类型为___________。
2.下列说法正确的是___________。
 ]广泛用于催化剂,汽油抗爆剂等,为黄色粘稠状液体,熔点为
]广泛用于催化剂,汽油抗爆剂等,为黄色粘稠状液体,熔点为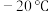 ,沸点为103℃,60℃在空气中可自燃,其结构和部分键长如图所示。
,沸点为103℃,60℃在空气中可自燃,其结构和部分键长如图所示。
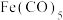 晶体类型为___________。
晶体类型为___________。| A.分子晶体 | B.离子晶体 | C.金属晶体 | D.共价晶体 |
A.中心Fe原子可能采取 杂化 杂化 |
| B.配体与Fe原子所形成的配位键的键能相同 |
| C.Fe在周期表中位于VIII族,属于d区元素 |
D.制备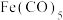 应在隔绝空气的条件下进行 应在隔绝空气的条件下进行 |
您最近一年使用:0次
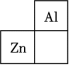
2 . 锌在工业中有重要作用,也是人体必需的微量元素。锌元素在周期表中的位置如图所示。___________ ,其核外电子共占据 ___________ 条轨道。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
(3)中医典籍中记载了炉甘石(ZnCO3)可用于治疗皮肤炎症或表面创伤。ZnCO3中,负离子的空间构型为 ___________ ,Zn、C、O的电负性由小到大的顺序是 ___________ 。
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
(4)Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供___________ ,Zn2+的杂化方式为 ___________ 。___________ 。
(6)根据上述信息,写出一种除去硫酸铝中的硫酸锌杂质的方法。___________
两种卤锌的性质如表所示:
(7)解释ZnCl2与ZnBr2熔点存在差异的原因 ___________ 。
(8)ZnF2晶胞如图所示,一个晶胞中含有___________ 个F﹣。
若NA表示阿伏加德罗常数的值,则ZnF2晶体(摩尔质量为M)的密度为___________ g•cm-3(用含a、c、M、NA的代数式表示,1nm=1×10-7cm)。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
| A.34Zn | B.34Zn | C.64Zn | D.64Zn |
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
(4)Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供

(6)根据上述信息,写出一种除去硫酸铝中的硫酸锌杂质的方法。
两种卤锌的性质如表所示:
| 卤化锌 | ZnCl2 | ZnBr2 |
| 熔点/℃ | 283 | 394 |
(8)ZnF2晶胞如图所示,一个晶胞中含有
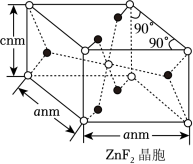
若NA表示阿伏加德罗常数的值,则ZnF2晶体(摩尔质量为M)的密度为
您最近一年使用:0次
名校
解题方法
3 . 制备锂离子电池的正极材料的前体 的一种流程如下:
的一种流程如下:
ii. 可溶于水,
可溶于水, 微溶于水
微溶于水
iii.
iv.
I.制备
1.用 溶液、
溶液、 溶液分步浸取磷灰石生成HF、
溶液分步浸取磷灰石生成HF、 和
和 ,主要反应的化学方程式为
,主要反应的化学方程式为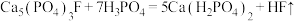 和
和
___________ 。
2.增大酸浸反应速率的措施有___________ (写1条)。
3.其他条件不变时,若仅用 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是___________ 。
II.制备
将 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。
4.酸性条件下,生成 的离子方程式是
的离子方程式是___________ 。
常温下,利用NaOH调节 溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
6. 时,溶液中的
时,溶液中的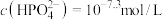 ,则
,则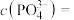
___________  ,再加入
,再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀___________ 。
 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
7.研究表明,沉淀时可加入含 的溶液,
的溶液, 的作用是
的作用是___________ 。
8.配离子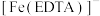 的结构如图所示,图中M代表
的结构如图所示,图中M代表 。EDTA中碳原子的杂化方式为
。EDTA中碳原子的杂化方式为___________ , 的配位数为
的配位数为___________ 。 而不是更高的pH制备
而不是更高的pH制备 ,可能的原因是
,可能的原因是___________ 、___________ (答出2点)。
 的一种流程如下:
的一种流程如下:

ii.
 可溶于水,
可溶于水, 微溶于水
微溶于水iii.

iv.

I.制备

1.用
 溶液、
溶液、 溶液分步浸取磷灰石生成HF、
溶液分步浸取磷灰石生成HF、 和
和 ,主要反应的化学方程式为
,主要反应的化学方程式为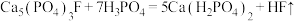 和
和
2.增大酸浸反应速率的措施有
3.其他条件不变时,若仅用
 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是II.制备

将
 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。4.酸性条件下,生成
 的离子方程式是
的离子方程式是常温下,利用NaOH调节
 溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。 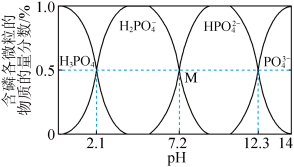
A. 的电离方程式为: 的电离方程式为: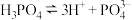 |
B.M点时,溶液中 |
C. 时,溶液 时,溶液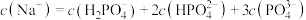 |
D. 时,溶液中水的电离程度比纯水大 时,溶液中水的电离程度比纯水大 |
 时,溶液中的
时,溶液中的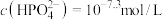 ,则
,则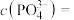
 ,再加入
,再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。7.研究表明,沉淀时可加入含
 的溶液,
的溶液, 的作用是
的作用是8.配离子
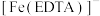 的结构如图所示,图中M代表
的结构如图所示,图中M代表 。EDTA中碳原子的杂化方式为
。EDTA中碳原子的杂化方式为 的配位数为
的配位数为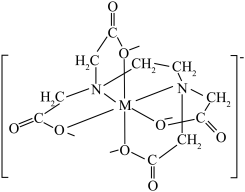
 而不是更高的pH制备
而不是更高的pH制备 ,可能的原因是
,可能的原因是
您最近一年使用:0次
4 . 如图为从预处理后的可充电电池粉末(主要为NiO、CdO、CoO和Fe2O3等)中回收重金属的工艺流程。 。写出NiO浸取时发生反应的化学方程式:
。写出NiO浸取时发生反应的化学方程式:_____ 。
2.已知Co(OH)3为强氧化剂,向Co(OH) 3中加入浓盐酸发生反应,写出该反应的离子方程式并用单线桥标出电子转移的方向和数目:_____ 。
3.“反萃取”的原理为NiR+2H+=Ni2++2HR有,需加入的试剂X为_____ 。
A.NaOH溶液 B.盐酸 C.硫酸溶液 D.Ni粉
“反萃取”后分离有机相和水相的操作为_____ 。
A.过滤 B.分液 C.蒸馏 D.重结晶
4.生成CdCO3沉淀是利用反应[Cd(NH3)4]2++
 CdCO3+4NH3,列式计算Ksp(CdCO3)
CdCO3+4NH3,列式计算Ksp(CdCO3)_____ 。【已知:常温下,该反应平衡常数K1=2.75×105,[Cd(NH3)4]2+ Cd2++4NH3的平衡常数K2=2.75×10−7】
Cd2++4NH3的平衡常数K2=2.75×10−7】

 。写出NiO浸取时发生反应的化学方程式:
。写出NiO浸取时发生反应的化学方程式:2.已知Co(OH)3为强氧化剂,向Co(OH) 3中加入浓盐酸发生反应,写出该反应的离子方程式并用单线桥标出电子转移的方向和数目:
3.“反萃取”的原理为NiR+2H+=Ni2++2HR有,需加入的试剂X为
A.NaOH溶液 B.盐酸 C.硫酸溶液 D.Ni粉
“反萃取”后分离有机相和水相的操作为
A.过滤 B.分液 C.蒸馏 D.重结晶
4.生成CdCO3沉淀是利用反应[Cd(NH3)4]2++

 CdCO3+4NH3,列式计算Ksp(CdCO3)
CdCO3+4NH3,列式计算Ksp(CdCO3) Cd2++4NH3的平衡常数K2=2.75×10−7】
Cd2++4NH3的平衡常数K2=2.75×10−7】
您最近一年使用:0次
5 . MnCl2可与NH3反应生成[Mn(NH3)6]Cl2,Mn2+与NH3之间的化学键为什么键
| A.π键 | B.σ键 | C.配位键 | D.离子键 |
您最近一年使用:0次
名校
解题方法
6 . 矾是一些金属硫酸盐的统称,其中皓矾的化学式为 ,可用作媒染剂、木材防腐剂。下图是
,可用作媒染剂、木材防腐剂。下图是 的结构示意图:
的结构示意图: 离子。
离子。
1. 分子的分子构型为
分子的分子构型为___________ ,中心原子杂化方式为___________ 杂化。
2. 的沸点
的沸点___________ (填>、<或=)水的沸点,原因可能是___________ 。
3. 中,
中, 与
与 间的作用力为
间的作用力为___________ , 与
与 间的作用力为
间的作用力为___________ 。
4. 与
与 中的中心原子均为
中的中心原子均为 杂化,
杂化, 中H—O—H键角
中H—O—H键角___________ (填>、<或=) 中O—S—O键角,原因是
中O—S—O键角,原因是___________ 。
5.写出 溶于氨水的化学方程式
溶于氨水的化学方程式___________ 。
6. 受热失水时,随着温度的升高,先失去一个水分子,变为
受热失水时,随着温度的升高,先失去一个水分子,变为 ,再失去其它的水,首先失去的水分子应为
,再失去其它的水,首先失去的水分子应为___________ (填①或②),原因是___________ 。
 ,可用作媒染剂、木材防腐剂。下图是
,可用作媒染剂、木材防腐剂。下图是 的结构示意图:
的结构示意图: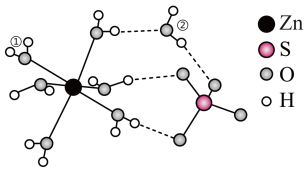
 离子。
离子。1.
 分子的分子构型为
分子的分子构型为2.
 的沸点
的沸点3.
 中,
中, 与
与 间的作用力为
间的作用力为 与
与 间的作用力为
间的作用力为4.
 与
与 中的中心原子均为
中的中心原子均为 杂化,
杂化, 中H—O—H键角
中H—O—H键角 中O—S—O键角,原因是
中O—S—O键角,原因是5.写出
 溶于氨水的化学方程式
溶于氨水的化学方程式6.
 受热失水时,随着温度的升高,先失去一个水分子,变为
受热失水时,随着温度的升高,先失去一个水分子,变为 ,再失去其它的水,首先失去的水分子应为
,再失去其它的水,首先失去的水分子应为
您最近一年使用:0次
7 . Cu2S溶于浓氨水中形成无色的[Cu(NH3)2]+,其中___________ 称为中心离子,它的空轨道接受了配位体提供的___________ ,形成___________ 键。
您最近一年使用:0次
解题方法
8 . 实验室可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3 与KSCN溶液混合,可得到配位数为5的配合物的化学式是___________ 。K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的 结构如图所示(K+未画出),则一个晶胞中的K+个数为
结构如图所示(K+未画出),则一个晶胞中的K+个数为___________ 。
 结构如图所示(K+未画出),则一个晶胞中的K+个数为
结构如图所示(K+未画出),则一个晶胞中的K+个数为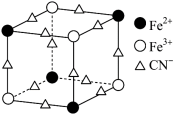
您最近一年使用:0次
解题方法
9 . 蛋氨酸铜的结构式如图。
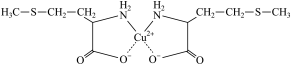
| A.配位键 | B.氢键 | C.离子键 | D.金属键 |
您最近一年使用:0次
解题方法
10 . 我国科学家研发的水系可逆Zn-CO2电池可吸收利用CO2.将两组正离子、负离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的H2O解离成H+和OH—,工作原理如图所示:_____ 。
(2)充电时复合膜中向多孔Pd纳米片极移动的离子是_____ ,放电时正极的电极反应式为_____ 。
(3)下列说法中正确的是_____。
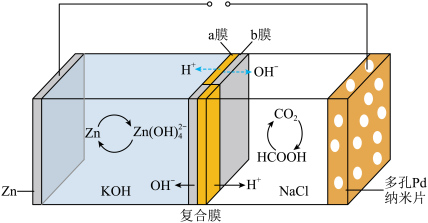
(2)充电时复合膜中向多孔Pd纳米片极移动的离子是
(3)下列说法中正确的是_____。
| A.放电时锌做阳极 |
| B.充电时多孔Pd纳米片极发生还原反应 |
| C.Na2[Zn(OH)4]中只存在离子键和配位键 |
D.Zn(OH) 可在足量稀硫酸中转化为Zn2+ 可在足量稀硫酸中转化为Zn2+ |
您最近一年使用:0次



