名校
1 . 自来水的硬度是指自来水中Ca的含量。用滴定法测定自来水的硬度的实验步骤如下:
①用移液管移取100.00mL自来水于250mL锥形瓶中(煮沸后冷却以除去溶解的CO2);
④用标准的EDTA溶液(用Na2H2 Y表示)滴定至终点,发生反应:H2Y2-+Ca2+=Ca(H2Y)。
(1)步骤②中的三乙醇胺是为了遮蔽自来水中其他会与EDTA配位的金属离子(如Fe3+等),形成如图所示的稳定配合物。下列说法正确的是___________。
(2)三乙醇胺与三价铁配位后,溶液的酸性___________ 。
A.增强 B.不变 C.减弱
NH3·H2O-NH4Cl缓冲液可维持滴定过程中溶液pH稳定,其原理是___________ 。
(3)铬黑T(如图)是一种金属离子指示剂,其本身为黑色粉末,水溶液显蓝色,下列关于铬黑T的说
法正确的是___________。
(4)判断滴定到达终点的依据是___________ 。
(5)滴定时使用标准0.0200mol/L的EDTA溶液,做三组平行实验,测得如下数据:
___________ 。
(6)计算自来水样品中钙离子的浓度。自来水中的Ca以CaCO3形式存在,我国规定生活用水的硬度 (CaCO3)不得超过450mg/L,判断该自来水硬度是否达标?(列式计算)
(CaCO3)不得超过450mg/L,判断该自来水硬度是否达标?(列式计算) ___________
①用移液管移取100.00mL自来水于250mL锥形瓶中(煮沸后冷却以除去溶解的CO2);
②加入3mL 三乙醇胺( )溶液与5mL NH3·H2O-NH4Cl缓冲液;
)溶液与5mL NH3·H2O-NH4Cl缓冲液;
④用标准的EDTA溶液(用Na2H2 Y表示)滴定至终点,发生反应:H2Y2-+Ca2+=Ca(H2Y)。
(1)步骤②中的三乙醇胺是为了遮蔽自来水中其他会与EDTA配位的金属离子(如Fe3+等),形成如图所示的稳定配合物。下列说法正确的是___________。

| A.三乙醇胺在核磁共振氢谱中只显示一组峰 | B.该配合物中的配位数与配体个数相等 |
| C.三乙醇胺不能与Ca2+和Mg2+配位 | D.该配合物只有内界,没有外界 |
(2)三乙醇胺与三价铁配位后,溶液的酸性
A.增强 B.不变 C.减弱
NH3·H2O-NH4Cl缓冲液可维持滴定过程中溶液pH稳定,其原理是
(3)铬黑T(如图)是一种金属离子指示剂,其本身为黑色粉末,水溶液显蓝色,下列关于铬黑T的说
法正确的是___________。
| 铬黑T 化学式:C20H12N3NaO7S 结构: |
| A.铬黑T中含有铬元素 | B.铬黑T与Ca2+、Fe3+均能显色 |
| C.可用红外光谱检验铬黑T中的官能团 | D.铬黑T能与NaHCO3反应放出CO2 |
(4)判断滴定到达终点的依据是
(5)滴定时使用标准0.0200mol/L的EDTA溶液,做三组平行实验,测得如下数据:
| 实验组号 | 1 | 2 | 3 |
| 消耗标准液的体积 | 20.02 | 19.98 | 如图所示 |

(6)计算自来水样品中钙离子的浓度。自来水中的Ca以CaCO3形式存在,我国规定生活用水的硬度
 (CaCO3)不得超过450mg/L,判断该自来水硬度是否达标?(列式计算)
(CaCO3)不得超过450mg/L,判断该自来水硬度是否达标?(列式计算)
您最近一年使用:0次
名校
解题方法
2 . 铁和硒都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。乙烷硒啉(Ethaselen)是一种抗癌新药,其结构如下:
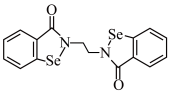
(1)基态Se原子的核外电子排布式为[Ar]_______ ,其核外有_______ 种不同能量的电子;该新药分子中的H被1个Cl取代,其可能的产物有_______ 种。
(2)在对电子运动状态的描述中,确定1个“轨道”的方面包括_______。
①电子层 ②电子云形状 ③电子云的伸展方向 ④电子的自旋
(3)比较键角大小:气态SeO3分子_______  离子(填“>”“<”或“=”)。
离子(填“>”“<”或“=”)。
(4)过渡元素离子一般能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子或离子是_______ 。
(5)富马酸亚铁FeC4H2O4是一种补铁剂。富马酸分子的结构模型如下图所示:

富马酸分子中σ键与π键的数目比为___ ,富马酸亚铁中各元素的电负性由大到小的顺序为___

(1)基态Se原子的核外电子排布式为[Ar]
(2)在对电子运动状态的描述中,确定1个“轨道”的方面包括_______。
①电子层 ②电子云形状 ③电子云的伸展方向 ④电子的自旋
| A.①②③④ | B.①②③ | C.①② | D.① |
 离子(填“>”“<”或“=”)。
离子(填“>”“<”或“=”)。(4)过渡元素离子一般能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子或离子是
(5)富马酸亚铁FeC4H2O4是一种补铁剂。富马酸分子的结构模型如下图所示:

富马酸分子中σ键与π键的数目比为
您最近一年使用:0次
3 . 锆(Zr)在核工业中地位重要,被称为“原子时代的头号金属”。一种以氧氯化锆[主要含ZrOCl2,还含少量Fe、Cr、Hf等的化合物]为原料生产锆的流程如下:
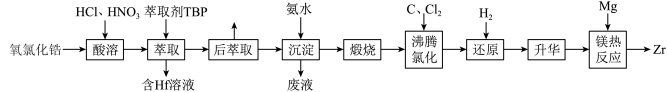
已知:①“酸溶”后溶液中各金属元素的存在形式为:ZrO2+、HfO2+、Fe3+、Cr3+;
②25℃,Ksp[Fe(OH)3]=4.0×10–38,Kb(NH3·H2O)=1.8×10–5;
③某些易升华的物质在接近沸点时升华速率较快。相关物质沸点如下:
1.Zr与Ti(钛)同族且在Ti的下一周期。Zr位于元素周期表的第_______周期,第_______族。
2.Zr的金属性比铁的金属性_______ 。
A.强 B.弱 C.无法确定
3.“萃取”时,ZrO2+生成配合物Zr(NO3)2Cl2·2TBP。下列对该配合物的分析错误的是_______。
4.“废液”中c( )/c(NH3·H2O)=1.8,则“废液”中c(Fe3+)=
)/c(NH3·H2O)=1.8,则“废液”中c(Fe3+)=_______ mol·L–1。
5.“沸腾氯化”时,金属均转化为相应的氯化物,写出含铁化合物在“沸腾氯化”时发生反应的化学方程式。_______ 。
6.结合题中沸点数据,推测“还原”的目的是_______ 。
7.FeCl3沸点远低于CrCl3的可能原因是_______ 。
8.某种掺杂CaO的ZrO2晶胞如图所示,Ca位于晶胞的面心。
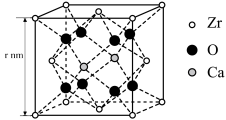
(1)晶体中每个O周围与其最近的O个数为_______ 。
(2)结合图中数据,计算该晶胞的密度ρ=_______ g·cm–3(设NA为阿伏加德罗常数,用含r和NA的代数式表示,1nm=1×10–7cm)。

已知:①“酸溶”后溶液中各金属元素的存在形式为:ZrO2+、HfO2+、Fe3+、Cr3+;
②25℃,Ksp[Fe(OH)3]=4.0×10–38,Kb(NH3·H2O)=1.8×10–5;
③某些易升华的物质在接近沸点时升华速率较快。相关物质沸点如下:
| 物质 | ZrCl4 | FeCl3 | CrCl3 | FeCl2 | CrCl2 |
| 沸点/℃ | 331 | 315 | 1300 | 700 | 1150 |
1.Zr与Ti(钛)同族且在Ti的下一周期。Zr位于元素周期表的第_______周期,第_______族。
| A.四、4 | B.四、IIB | C.五、IVB | D.五、IIB |
A.强 B.弱 C.无法确定
3.“萃取”时,ZrO2+生成配合物Zr(NO3)2Cl2·2TBP。下列对该配合物的分析错误的是_______。
| A.锆提供空轨道 | B.一定含配位键 |
| C.配体数一定为6 | D.可由分子光谱、晶体X射线确定其结构 |
 )/c(NH3·H2O)=1.8,则“废液”中c(Fe3+)=
)/c(NH3·H2O)=1.8,则“废液”中c(Fe3+)=5.“沸腾氯化”时,金属均转化为相应的氯化物,写出含铁化合物在“沸腾氯化”时发生反应的化学方程式。
6.结合题中沸点数据,推测“还原”的目的是
7.FeCl3沸点远低于CrCl3的可能原因是
8.某种掺杂CaO的ZrO2晶胞如图所示,Ca位于晶胞的面心。

(1)晶体中每个O周围与其最近的O个数为
(2)结合图中数据,计算该晶胞的密度ρ=
您最近一年使用:0次
4 . 锌是生命中不可或缺的微量元素,有“生命火花”之称。硫酸锌常用作动植物补锌试剂,工业上,硫酸锌可由菱锌矿制备,菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如图:

本题中所涉及离子的氢氧化物溶度积常数如表:
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为_______ 。
(2)为了提高锌的浸取效果,可采取的措施有_______ 、_______ 。
(3)加入物质X调节溶液pH=5,以下试剂能实现该目的是_______ 。
A.NH3•H2O B.Ca(OH)2 C.NaOH D.MgO
滤渣①的主要成分是_______ 。
(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该反应的离子方程式为_______ 。
(5)滤液②中加入锌粉的目的是_______ 。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是_______ 。
(7)硫酸锌溶液与过量氨水反应可生成配离子[Zn(NH3)4]2+,其结构如图所示:

①请在结构图中用箭头标出配位键_______ 。
②该配离子所含配体的分子空间构型为_______ 。

本题中所涉及离子的氢氧化物溶度积常数如表:
| 离子 | Fe3+ | Zn2+ | Cu2+ | Fe2+ | Mg2+ |
| Ksp | 4.0×10-38 | 6.7×10-17 | 2.2×10-20 | 8.0×10-16 | 1.8×10-11 |
(1)菱锌矿焙烧生成氧化锌的化学方程式为
(2)为了提高锌的浸取效果,可采取的措施有
(3)加入物质X调节溶液pH=5,以下试剂能实现该目的是
A.NH3•H2O B.Ca(OH)2 C.NaOH D.MgO
滤渣①的主要成分是
(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该反应的离子方程式为
(5)滤液②中加入锌粉的目的是
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是
(7)硫酸锌溶液与过量氨水反应可生成配离子[Zn(NH3)4]2+,其结构如图所示:

①请在结构图中用箭头标出配位键
②该配离子所含配体的分子空间构型为
您最近一年使用:0次
名校
解题方法
5 . 铁是工业生产中不可缺少的一种金属。请回答下列问题:
(1)Fe元素在元素周期表中的位置_______ ,Fe原子的价层电子排布式为_______ 。
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如图所示:

①α—Fe晶体中每个铁原子周围与它最接近且距离相等的铁原子有_______ 个。
②γ—Fe晶体晶胞中所含有的铁原子数为_______ 。
③若δ—Fe晶体的晶胞边长为a cm, 表示阿伏加德罗常数的值,则δ—Fe单质的密度为
表示阿伏加德罗常数的值,则δ—Fe单质的密度为_______  (列出算式即可)。
(列出算式即可)。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁的晶体类型为_______ 。
(4)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。

①此配离子中_______ 原子提供孤电子对,_______ 原子提供空轨道。
②此配离子中碳原子的杂化轨道类型有_______ 。
(5)(多选)此配离子中含有的化学键有_______ 。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G. δ键 H. π键
(1)Fe元素在元素周期表中的位置
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如图所示:

①α—Fe晶体中每个铁原子周围与它最接近且距离相等的铁原子有
②γ—Fe晶体晶胞中所含有的铁原子数为
③若δ—Fe晶体的晶胞边长为a cm,
 表示阿伏加德罗常数的值,则δ—Fe单质的密度为
表示阿伏加德罗常数的值,则δ—Fe单质的密度为 (列出算式即可)。
(列出算式即可)。(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁的晶体类型为
(4)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。

①此配离子中
②此配离子中碳原子的杂化轨道类型有
(5)(多选)此配离子中含有的化学键有
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G. δ键 H. π键
您最近一年使用:0次
2023-03-27更新
|
312次组卷
|
2卷引用:上海市建平中学2022-2023学年高二下学期3月测试化学(B 卷)试题




