名校
解题方法
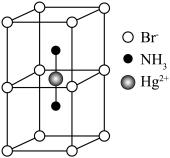
1 . X射线研究表明 是共价化合物,为平面链状结构,以
是共价化合物,为平面链状结构,以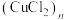 形式存在,如图所示。
形式存在,如图所示。 易溶于水、乙醇、丙酮和氨水等,其水溶液常呈绿色,原因是
易溶于水、乙醇、丙酮和氨水等,其水溶液常呈绿色,原因是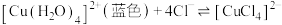
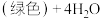 ,下列说法错误的是
,下列说法错误的是
 是共价化合物,为平面链状结构,以
是共价化合物,为平面链状结构,以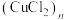 形式存在,如图所示。
形式存在,如图所示。 易溶于水、乙醇、丙酮和氨水等,其水溶液常呈绿色,原因是
易溶于水、乙醇、丙酮和氨水等,其水溶液常呈绿色,原因是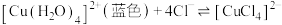
 ,下列说法错误的是
,下列说法错误的是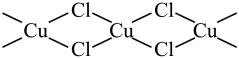
A.由图结构可知 中存在配位键 中存在配位键 |
B. 溶液中加入NaCl固体,可使溶液颜色变绿 溶液中加入NaCl固体,可使溶液颜色变绿 |
C. 中加入过量氨水可生成含 中加入过量氨水可生成含 深蓝色溶液,说明 深蓝色溶液,说明 配位能力大于 配位能力大于 |
D.1mol  中存在4 中存在4 个σ键 个σ键 |
您最近半年使用:0次
名校
解题方法
2 . 氮元素是重要的非金属元素,可形成多种铵盐、氮化物、叠氮化物及配合物等。
(1)基态氮原子价电子的轨道表示式(价电子排布图)为___________ ;第二周期元素原子中第一电离能大于氮原子的有___________ 种, 中阴离子的空间构型为
中阴离子的空间构型为___________ 。
(2)C、N、O、S四种元素中,电负性最大的是___________ 。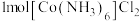 中含有σ键的数目为
中含有σ键的数目为___________ ;已知 比
比 的沸点低得多,试解释原因
的沸点低得多,试解释原因___________ 。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为螯合物。一种 配合物的结构如图所示,1mol该螯合物中通过鳌合作用形成的配位键有
配合物的结构如图所示,1mol该螯合物中通过鳌合作用形成的配位键有___________ mol。 作简单立方堆积,两个立方体共用的面中心存在一个
作简单立方堆积,两个立方体共用的面中心存在一个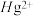 ,
, 位于立方体的体心,相邻的
位于立方体的体心,相邻的 的距离均为apm,阿伏加德罗常数的值为
的距离均为apm,阿伏加德罗常数的值为 ,该物质的化学式为
,该物质的化学式为___________ ,该晶体的密度为___________  。
。 可以与
可以与 、
、 等形成配合物。与
等形成配合物。与 互为等电子体且为非极性分子的化学式为
互为等电子体且为非极性分子的化学式为___________ 。在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为___________ ,两种晶体中空间利用率较高的是___________ 。(填“图1”或“图2”)
(1)基态氮原子价电子的轨道表示式(价电子排布图)为
 中阴离子的空间构型为
中阴离子的空间构型为(2)C、N、O、S四种元素中,电负性最大的是
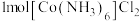 中含有σ键的数目为
中含有σ键的数目为 比
比 的沸点低得多,试解释原因
的沸点低得多,试解释原因(3)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为螯合物。一种
 配合物的结构如图所示,1mol该螯合物中通过鳌合作用形成的配位键有
配合物的结构如图所示,1mol该螯合物中通过鳌合作用形成的配位键有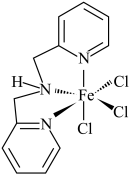
 作简单立方堆积,两个立方体共用的面中心存在一个
作简单立方堆积,两个立方体共用的面中心存在一个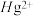 ,
, 位于立方体的体心,相邻的
位于立方体的体心,相邻的 的距离均为apm,阿伏加德罗常数的值为
的距离均为apm,阿伏加德罗常数的值为 ,该物质的化学式为
,该物质的化学式为 。
。
 可以与
可以与 、
、 等形成配合物。与
等形成配合物。与 互为等电子体且为非极性分子的化学式为
互为等电子体且为非极性分子的化学式为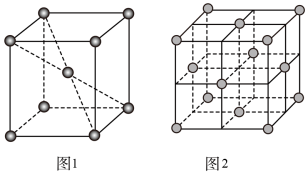
您最近半年使用:0次
3 . 下列关于分子的结构和性质的描述中,错误的是
| A.冠醚利用不同大小的空穴适配不同大小的碱金属离子进行“分子识别” |
B.乳酸(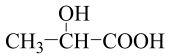 )分子中含有一个手性碳原子 )分子中含有一个手性碳原子 |
| C.碘易溶于浓碘化钾溶液,甲烷难溶于水都可用“相似相溶”原理解释 |
| D.分子极性HF>HCl>HBr>HI |
您最近半年使用:0次
4 . 向盛有CuSO4溶液的试管中加入少量氨水,现象是_______ ;继续添加氨水,得到深蓝色透明溶液,该步骤的离子方程式为_______ ;若要得到深蓝色晶体,需进行的操作是_______ ,所得晶体的化学式为_______ 。AgCl沉淀也能溶解在氨水中,生成的配合物中配体的空间结构名称为_______ ,Ag+的配位数是_______ ,继续向溶液中加入足量HNO3溶液,观察到的现象是_______ 。
您最近半年使用:0次
5 . ZnO在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Mn等元素)制备。工艺如图所示:
已知:①“溶浸”后的溶液中金属离子主要有:Zn2+、Fe2+、Cd2+、Mn2+、Ni2+。
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+>Cd2+>Zn2+。
(1)基态Zn原子的核外电子排布式为___________ ,铁在元素周期表中的位置为___________ ,Ni2+和Fe2+可形成如图所示的配合物离子,其中铁的一个配体为茂环阴离子(C5H ),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有
),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有___________ 个,S元素的杂化方式为___________ 。 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量___________ (填化学式)调节至弱酸性(pH为5.5)。此时溶液中 的最大浓度是
的最大浓度是___________ 。
(3)加 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和___________ 。
(4)“还原除杂”除去的离子是___________ 。
(5)生成碱式碳酸锌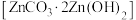 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式___________ 。碱式碳酸锌灼烧后得到ZnO,ZnO的一种晶体的晶胞是立方晶胞(如图所示),晶胞参数为apm,该晶胞的密度为___________ g/cm3,请在图中画出该晶胞沿 轴方向的平面投影图
轴方向的平面投影图___________ 。

| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ | Mn2+ | Ni2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.0 | 7.4 | 8.1 | 6.9 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.0 | 9.4 | 10.1 | 8.9 |
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+>Cd2+>Zn2+。
(1)基态Zn原子的核外电子排布式为
 ),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有
),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有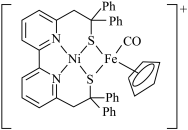
 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量 的最大浓度是
的最大浓度是(3)加
 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和(4)“还原除杂”除去的离子是
(5)生成碱式碳酸锌
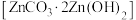 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式 轴方向的平面投影图
轴方向的平面投影图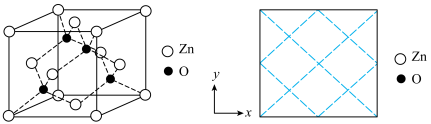
您最近半年使用:0次
6 . 已知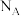 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
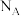 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A. 和 和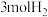 反应形成的 反应形成的 键数目为 键数目为 |
B. 固体溶于 固体溶于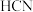 酸所得溶液显中性, 酸所得溶液显中性,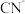 的数目为 的数目为 |
C. 固体中含有氨气分子数目为 固体中含有氨气分子数目为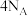 |
D. 与 与 充分反应,转移的电子数目为 充分反应,转移的电子数目为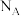 |
您最近半年使用:0次
名校
解题方法
7 . 废定影液的主要成分为 ,以废定影液为原料制备
,以废定影液为原料制备 的工艺流程如图:
的工艺流程如图: )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
②常温下, 稳
稳 ;
; 。
。
(1)硫化钠溶液显碱性,其原因为___________ (用离子方程式表示)。
(2)比较S原子和O原子的电负性大小,并从原子结构的角度说明理由:___________ 。
(3) 的空间结构是
的空间结构是___________ 。
(4)常温下,“沉淀”时发生的反应为 ,平衡时,
,平衡时,
___________ (列出计算式即可)。
(5)“反应”时有淡黄色固体生成,发生反应的化学方程式为___________ 。
(6)MgS2O3·6H2O的晶胞形状为长方体,结构如图所示。 个数为
个数为___________ 。晶体中微粒间作用力有___________ (填标号)。
a.氢键 b.离子键 c.极性共价键 d.配位键
 ,以废定影液为原料制备
,以废定影液为原料制备 的工艺流程如图:
的工艺流程如图: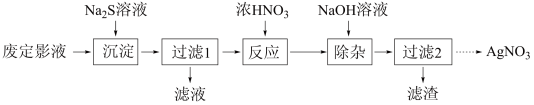
 )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。②常温下,
 稳
稳 ;
; 。
。(1)硫化钠溶液显碱性,其原因为
(2)比较S原子和O原子的电负性大小,并从原子结构的角度说明理由:
(3)
 的空间结构是
的空间结构是(4)常温下,“沉淀”时发生的反应为
 ,平衡时,
,平衡时,
(5)“反应”时有淡黄色固体生成,发生反应的化学方程式为
(6)MgS2O3·6H2O的晶胞形状为长方体,结构如图所示。
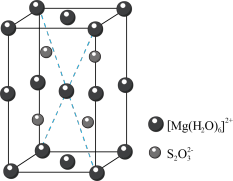
 个数为
个数为a.氢键 b.离子键 c.极性共价键 d.配位键
您最近半年使用:0次
昨日更新
|
44次组卷
|
2卷引用:福建省厦门市国祺中学2023-2024学年高三上学期第三次月考化学试题
解题方法
8 . 氮、磷、砷等元素的单质及化合物在生产、生活中应用广泛。回答下列问题:
(1)基态砷原子的价层电子的轨道表示式为__________________ 。
(2)基态氮原子核外电子占据的最高能级的原子轨道的形状为_____________ ;氮、磷、砷的简单氢化物 、
、 、
、 的空间结构均为
的空间结构均为__________ 形,键角由大到小的顺序为_________________ (填化学式),分析原因:____________________________ 。
(3) 与N—甲基咪唑(
与N—甲基咪唑( )反应可以得到
)反应可以得到 ,其结构如图所示。
,其结构如图所示。 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则N—甲基咪唑分子中的大
键的电子数,则N—甲基咪唑分子中的大 键可表示为
键可表示为___________ 。
(4)研究发现固态 和
和 均为离子晶体,但结构分别为
均为离子晶体,但结构分别为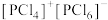 和
和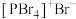 ,分析固态
,分析固态 和
和 结构存在差异的原因:
结构存在差异的原因:___________ 。
下列关于 、
、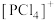 和[
和[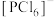 的结构的推断错误的是
的结构的推断错误的是___________ (填标号)。
A.气态 分子中P原子为
分子中P原子为 杂化
杂化
B.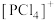 的空间结构为正四面体形
的空间结构为正四面体形
C.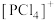 和
和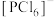 中P原子的杂化类型相同
中P原子的杂化类型相同
(1)基态砷原子的价层电子的轨道表示式为
(2)基态氮原子核外电子占据的最高能级的原子轨道的形状为
 、
、 、
、 的空间结构均为
的空间结构均为(3)
 与N—甲基咪唑(
与N—甲基咪唑( )反应可以得到
)反应可以得到 ,其结构如图所示。
,其结构如图所示。
 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则N—甲基咪唑分子中的大
键的电子数,则N—甲基咪唑分子中的大 键可表示为
键可表示为(4)研究发现固态
 和
和 均为离子晶体,但结构分别为
均为离子晶体,但结构分别为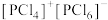 和
和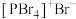 ,分析固态
,分析固态 和
和 结构存在差异的原因:
结构存在差异的原因:下列关于
 、
、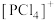 和[
和[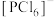 的结构的推断错误的是
的结构的推断错误的是A.气态
 分子中P原子为
分子中P原子为 杂化
杂化B.
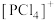 的空间结构为正四面体形
的空间结构为正四面体形C.
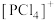 和
和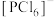 中P原子的杂化类型相同
中P原子的杂化类型相同
您最近半年使用:0次
9 . 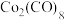 经过
经过 活化后生成的
活化后生成的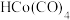 ,可用于催化某些有机反应,机理如下:
,可用于催化某些有机反应,机理如下:
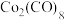 经过
经过 活化后生成的
活化后生成的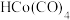 ,可用于催化某些有机反应,机理如下:
,可用于催化某些有机反应,机理如下: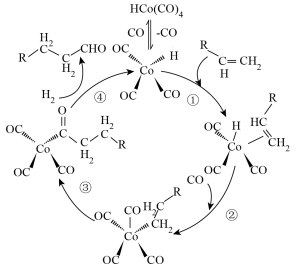
A.催化过程中 的化合价发生了变化 的化合价发生了变化 |
B.烯烃 键电子可提供给钴形成配位键 键电子可提供给钴形成配位键 |
C.催化 可生成 可生成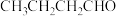 |
D.机理中碳原子的杂化方式有 、 、 、 、 |
您最近半年使用:0次
10 . 配合物中,中心体价电子数目和配体提供的电子数目之和等于18,可称为是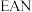 规则。
规则。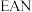 规则适用于羰基、亚硝酰基、
规则适用于羰基、亚硝酰基、 -配合物等。
-配合物等。
工业精炼 时,可用两个过程获取高纯度
时,可用两个过程获取高纯度 ,反应原理为
,反应原理为 ,
, 。
。
二茂铁是由2个环戊二烯负离子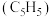 和亚铁离子形成的夹心结构。二茂铁和环戊二烯的结构分别如图所示:
和亚铁离子形成的夹心结构。二茂铁和环戊二烯的结构分别如图所示:
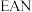 规则。
规则。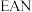 规则适用于羰基、亚硝酰基、
规则适用于羰基、亚硝酰基、 -配合物等。
-配合物等。工业精炼
 时,可用两个过程获取高纯度
时,可用两个过程获取高纯度 ,反应原理为
,反应原理为 ,
, 。
。二茂铁是由2个环戊二烯负离子
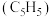 和亚铁离子形成的夹心结构。二茂铁和环戊二烯的结构分别如图所示:
和亚铁离子形成的夹心结构。二茂铁和环戊二烯的结构分别如图所示: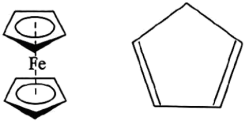
A.根据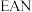 规则推测可形成配合物 规则推测可形成配合物 |
B.环戊二烯负离子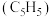 中存在 中存在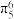 |
| C.环戊二烯分子中所有原子共面 |
D.工业精炼 时, 时, 为分子晶体,沸点低,有利于分离 为分子晶体,沸点低,有利于分离 |
您最近半年使用:0次



