名校
解题方法
1 . 钠是一种活泼金属,其单质及化合物在科研、生产中有重要的作用。
(1)基态钠原子核外电子的空间运动状态有___________ 种。
(2)冰晶石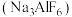 是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),
是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),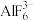 占据的位置相当于氯化钠晶胞中
占据的位置相当于氯化钠晶胞中 占据的位置。
占据的位置。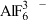 是正八面体结构,中心原子的杂化方式是
是正八面体结构,中心原子的杂化方式是___________ (填字母)。
A. B.
B. C.
C. D.
D.
② 晶体中存在的作用力有
晶体中存在的作用力有___________ (填字母)。
A.非极性共价键 B.配位键 C.范德华力 D.离子键
(3) 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,其原因是
,其原因是___________ 。
(4)硼氢化钠是一种常用的还原剂和催化剂。硼氢化钠的晶胞结构如图所示。 ,硼氢化钠溶于水的化学方程式为
,硼氢化钠溶于水的化学方程式为___________ ,硼氢化钠晶胞中与 紧邻的
紧邻的 个数是
个数是___________ 。
(5)有研究表明,在超高压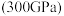 下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成
下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成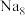 立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示:
立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示: 的最短距离为
的最短距离为___________  (用含a的代数式表示)。
(用含a的代数式表示)。
(1)基态钠原子核外电子的空间运动状态有
(2)冰晶石
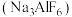 是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),
是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),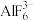 占据的位置相当于氯化钠晶胞中
占据的位置相当于氯化钠晶胞中 占据的位置。
占据的位置。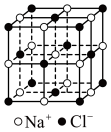
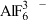 是正八面体结构,中心原子的杂化方式是
是正八面体结构,中心原子的杂化方式是A.
 B.
B. C.
C. D.
D.
②
 晶体中存在的作用力有
晶体中存在的作用力有A.非极性共价键 B.配位键 C.范德华力 D.离子键
(3)
 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,其原因是
,其原因是(4)硼氢化钠是一种常用的还原剂和催化剂。硼氢化钠的晶胞结构如图所示。
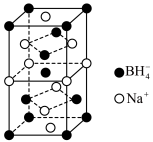
 ,硼氢化钠溶于水的化学方程式为
,硼氢化钠溶于水的化学方程式为 紧邻的
紧邻的 个数是
个数是(5)有研究表明,在超高压
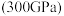 下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成
下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成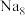 立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示:
立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示: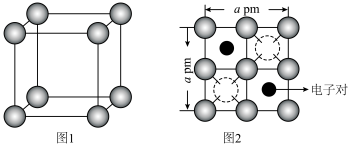
 的最短距离为
的最短距离为 (用含a的代数式表示)。
(用含a的代数式表示)。
您最近一年使用:0次
名校
解题方法
2 . 金属钛(Ti)被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)基态Ti原子的价电子轨道表示式为___________ 。
(2)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是___________ 。
(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
① 乙二胺中,N原子的杂化方式为___________ ,C、H、N的电负性由大到小的顺序为___________ 。
② 1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为___________ mol。
③ 乙二胺形成配合物后,H—N—H键角将变大,原因是___________ 。___________ pm(列出计算式)。
(1)基态Ti原子的价电子轨道表示式为
(2)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
① 乙二胺中,N原子的杂化方式为
② 1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为
③ 乙二胺形成配合物后,H—N—H键角将变大,原因是

您最近一年使用:0次
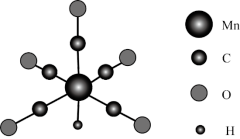
3 . 金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。
(1)基态锰原子的简化电子排布式为___________ 。
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为___________ 。
(3)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为___________ 。
(4)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是___________ 。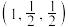 ,b点锰原子坐标为
,b点锰原子坐标为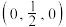 ,则c点锰原子坐标为
,则c点锰原子坐标为___________ 。
(1)基态锰原子的简化电子排布式为
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为
(3)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为
(4)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是
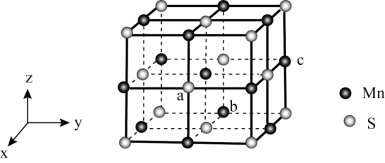
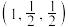 ,b点锰原子坐标为
,b点锰原子坐标为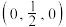 ,则c点锰原子坐标为
,则c点锰原子坐标为
您最近一年使用:0次
名校
解题方法
4 . 钴及其化合物在工业生产中具有广泛的用途,特别是作为工业生产的催化剂,钴及其化合物发挥了重要的作用。请回答下列问题:
(1)钴及其化合物广泛用作催化剂,说明钴元素在元素周期表中的位置为_______(填字母)。
(2)中国科学院院士、大连化学物理研究所研究员张涛及其团队开发出新型双原子催化剂(DACs),在丙烷脱氢性能上,该新型双原子催化剂优于单原子催化剂,其催化原理如图所示:_______ ,N原子为 杂化,未杂化的p轨道中容纳的电子数为
杂化,未杂化的p轨道中容纳的电子数为_______ 个;Zn或Co与N原子形成配位键时,提供孤电子对的原子是_______ (填元素符号);丙烷分解为丙烯的过程中,形成的化学键有_______ (填字母)。
A. 键 B.σ键 C.π键
键 B.σ键 C.π键
(3)CoO是石油化工中的一种催化剂,一种CoO的晶胞结构如图所示,该立方晶胞边长为a pm,设阿伏加德罗常数的值为 。
。 的分数坐标为
的分数坐标为_______ ;每个 周围与其距离最近且相等的
周围与其距离最近且相等的 共有
共有_______ 个;该CoO晶体的密度是_______ g⋅cm (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)钴及其化合物广泛用作催化剂,说明钴元素在元素周期表中的位置为_______(填字母)。
| A.主族元素 | B.金属与非金属分界线 |
| C.稀土元素 | D.过渡金属元素 |
(2)中国科学院院士、大连化学物理研究所研究员张涛及其团队开发出新型双原子催化剂(DACs),在丙烷脱氢性能上,该新型双原子催化剂优于单原子催化剂,其催化原理如图所示:

 杂化,未杂化的p轨道中容纳的电子数为
杂化,未杂化的p轨道中容纳的电子数为A.
 键 B.σ键 C.π键
键 B.σ键 C.π键(3)CoO是石油化工中的一种催化剂,一种CoO的晶胞结构如图所示,该立方晶胞边长为a pm,设阿伏加德罗常数的值为
 。
。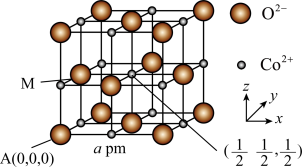
 的分数坐标为
的分数坐标为 周围与其距离最近且相等的
周围与其距离最近且相等的 共有
共有 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-05-07更新
|
111次组卷
|
2卷引用:2024届海南省琼海市嘉积中学高三下学期模拟预测化学试题
名校
解题方法
5 . 锌在工业中有重要作用,也是人体必须的微量元素。人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。碳酸酐酶的部分结构如图所示:
(1)Zn基态原子核外电子排布式_______ 。
(2)碳酸酐酶的部分结构中与Zn2+配位的原子是____ (填元素符号),该物质中碳原子的轨道杂化类型是_____ ,碳酸酐酶中H—O—H键角比H2O中H—O—H键角___ (填“大于”“小于”或“等于”)。
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第二电离能I2(Zn)_____ I2(Cu)(填“大于”或“小于”),原因是_____ 。
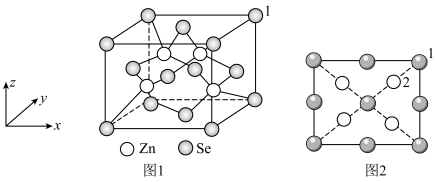
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图1所示。
①与 原子距离最近且等距离的
原子距离最近且等距离的 的个数为
的个数为_______ 。
②1号原子的坐标为 ,图2是
,图2是 晶胞沿z轴的投影图,2号原子的坐标为
晶胞沿z轴的投影图,2号原子的坐标为_______ 。
③晶胞中距离最近的两个Se的距离为a nm,设 为阿伏加德罗常数的值,该晶体密度为
为阿伏加德罗常数的值,该晶体密度为_______  。
。
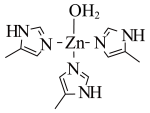
(1)Zn基态原子核外电子排布式
(2)碳酸酐酶的部分结构中与Zn2+配位的原子是
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第二电离能I2(Zn)
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图1所示。
①与
 原子距离最近且等距离的
原子距离最近且等距离的 的个数为
的个数为②1号原子的坐标为
 ,图2是
,图2是 晶胞沿z轴的投影图,2号原子的坐标为
晶胞沿z轴的投影图,2号原子的坐标为③晶胞中距离最近的两个Se的距离为a nm,设
 为阿伏加德罗常数的值,该晶体密度为
为阿伏加德罗常数的值,该晶体密度为 。
。
您最近一年使用:0次
6 . 铁及铁的化合物在生产、生活中有广泛应用。请回答下列问题:
(1)铁氰化钾常用来检验 ,现象为
,现象为_______ 。取少量铁氰化钾的水溶液于试管中,然后再滴加几滴硫氰化钾溶液,现象是否变红_______ (填“是”或“否”)。
(2)工业上常利用 与
与 形成稳定六氰合亚铁离子的特性来处理含
形成稳定六氰合亚铁离子的特性来处理含 的工业废水。
的工业废水。 的电子式
的电子式_______ , 与
与 生成六氰合亚铁离子的离子方程式
生成六氰合亚铁离子的离子方程式________ 。
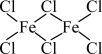
(3)三氯化铁易溶于水,也易溶于乙醚等有机溶剂。它在300℃以上易升华,在400℃时其蒸气中有以配位键结合的双聚分子存在,其结构如图所示。请判断三氯化铁的晶体类型为_______ 。______ 。
(1)铁氰化钾常用来检验
 ,现象为
,现象为(2)工业上常利用
 与
与 形成稳定六氰合亚铁离子的特性来处理含
形成稳定六氰合亚铁离子的特性来处理含 的工业废水。
的工业废水。 的电子式
的电子式 与
与 生成六氰合亚铁离子的离子方程式
生成六氰合亚铁离子的离子方程式(3)三氯化铁易溶于水,也易溶于乙醚等有机溶剂。它在300℃以上易升华,在400℃时其蒸气中有以配位键结合的双聚分子存在,其结构如图所示。请判断三氯化铁的晶体类型为

您最近一年使用:0次
名校
7 . 下列对有关事实的解释错误的是
| 事 实 | 解 释 | |
| A. | BF3与NH3形成配合物[H3N→BF3] | BF3中的B有空轨道接受NH3中N的孤电子对 |
| B. | 邻羟基苯甲醛比对羟基苯甲醛的沸点低 | 前者形成分子内氢键,后者形成分子间氢键 |
| C. | 壁虎在天花板上爬行自如 | 壁虎足与墙体之间存在范德华力 |
| D. | DNA是超分子 | DNA中两条分子链之间通过化学键的作用而组合在一起 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
8 . 冠醚能与阳离子作用,将阳离子以及对应的阴离子都带入有机溶剂。例如KMnO4水溶液对烯烃的氧化效果较差,在烯烃中溶入冠醚,可使氧化反应迅速发生,原理如图。
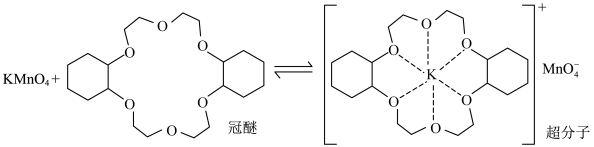
下列说法错误的是
| A.冠醚属于超分子 |
| B.冠醚中C、O原子间的化学键为σ键 |
| C.K+通过配位键与冠醚相结合 |
D.冠醚与K+结合后将 带入烯烃中, 带入烯烃中, 与烯烃充分接触而迅速反应 与烯烃充分接触而迅速反应 |
您最近一年使用:0次
名校
解题方法
9 . 铁(Fe)、钴(Co)、镍(Ni)是第四周期第VIII族的元素,称为铁系元素,相关化合物在生产生活中应用广泛。
(1)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知室温时Fe(CO)5为浅黄色液体,沸点103℃,则Fe(CO)5中含有的化学键类型包括____________ (填字母)。
A.极性键 B.非极性键 C.配位键 D.金属键 E.离子键
(2)镍能形成多种配合物,如 、
、 、
、 等,下列有关说法正确的是___________(填字母)。
等,下列有关说法正确的是___________(填字母)。
(3)Co3+的一种配离子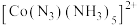 中,Co3+的配位数是
中,Co3+的配位数是_____________ ,Fe、Co、Ni与Ca都位于第四周期且最外层电子数相同,但相应单质的熔点,Fe、Co、Ni明显高于Ca,其原因是_____________ 。
(4)NiO晶胞与NaCl晶胞相似,如图所示_____________ 个;每个氧离子周围与它最近且相等距离的氧离子有_________ 个。
(1)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知室温时Fe(CO)5为浅黄色液体,沸点103℃,则Fe(CO)5中含有的化学键类型包括
A.极性键 B.非极性键 C.配位键 D.金属键 E.离子键
(2)镍能形成多种配合物,如
 、
、 、
、 等,下列有关说法正确的是___________(填字母)。
等,下列有关说法正确的是___________(填字母)。A.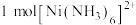 中含有 中含有 键的数目为 键的数目为 |
B. 中配体是CO,配位原子是C 中配体是CO,配位原子是C |
| C.NH3中N原子为sp3杂化,其空间构型为正四面体形 |
| D.Ni2+在形成配合物时其配位数只能为4,Fe在形成配合物时其配位数只能为5 |
(3)Co3+的一种配离子
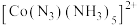 中,Co3+的配位数是
中,Co3+的配位数是(4)NiO晶胞与NaCl晶胞相似,如图所示
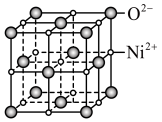
您最近一年使用:0次
2024-03-23更新
|
357次组卷
|
2卷引用:海南省琼海市嘉积中学2023-2024学年高二下学期月考化学试题
10 . 铁、铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为___________ 。
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。在蒸气中也容易双聚,据此判断三氯化铁晶体为___________ (填“分子晶体”或“离子晶体”)。
(3)(NH4)2Fe(SO4)2∙6H2O俗称摩尔盐,其阴离子 的空间构型为
的空间构型为___________ 。
(4)Fe(CO)5可用作催化剂、汽油抗爆剂等,其分子中σ键和π键的数目之比为___________ 。CO的沸点高于N2的原因是___________ 。
(5)CuCl2和CuCl是铜的两种氯化物。
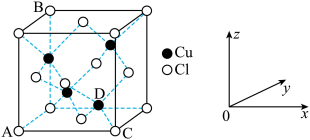
①图中表示的是___________ (填“CuCl2”或“CuCl”)的晶胞。
②原子坐标参数可用来表示晶胞内各原子的相对位置,图中各原子坐标参数A为 (0,0,0);B为(0,1,1);C为(1,0,0);则D原子的坐标参数为___________ 。
(1)基态Fe原子的价层电子的电子排布图为
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。在蒸气中也容易双聚,据此判断三氯化铁晶体为
(3)(NH4)2Fe(SO4)2∙6H2O俗称摩尔盐,其阴离子
 的空间构型为
的空间构型为(4)Fe(CO)5可用作催化剂、汽油抗爆剂等,其分子中σ键和π键的数目之比为
(5)CuCl2和CuCl是铜的两种氯化物。

①图中表示的是
②原子坐标参数可用来表示晶胞内各原子的相对位置,图中各原子坐标参数A为 (0,0,0);B为(0,1,1);C为(1,0,0);则D原子的坐标参数为
您最近一年使用:0次



