1 . 人类对第二周期的元素及化合物认识最早。
(1)第二周期的元素中,I1(第一电离能)从大到小排前三位的是_______ 。
(2)人类合成的第一个稀有气体化合物是XeF+PtF ,PtF
,PtF 中的键角有90°和180°两种。下列关于该化合物的说法中正确的是_______。
中的键角有90°和180°两种。下列关于该化合物的说法中正确的是_______。
(3)XeF+PtF 溶于水可生成Xe和HPtF6,写出反应的化学方程式。
溶于水可生成Xe和HPtF6,写出反应的化学方程式。_______ 。
(4)解释HNO3和HNO2酸性强弱不同的原因_______ 。
(5)SCN—中C原子的杂化类型为_______ , 其中含有两个相同的大π键,其形式为_______ 。(用π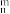 表示,n为原子数,m为电子数),检验Fe3+时,SCN—以 S原子配位不以N原子配位的原因是
表示,n为原子数,m为电子数),检验Fe3+时,SCN—以 S原子配位不以N原子配位的原因是_______ 。
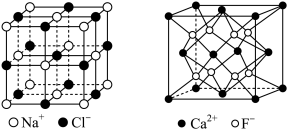
(6)如图,在NaCl的晶体中,Na+和Cl—互相占据对方的正八面体空隙,CaF2晶体中,F—占据由Ca2+构成的所有正四面体空隙。钛镍合金具有形状记忆功能。某钛、镍原子个数比为2:1的合金的晶体结构为:镍原子呈面心立方排列,钛原子填充在由镍原子围成的所有八面体空隙和一半的四面体空隙中,若最近的钛原子和镍原子紧密接触,镍原子周围距离最近的钛原子数为_______ ; 钛原子和镍原子的半径分别为r1和r2,该晶体的空间利用率为_______ (用含r的代数式表示,不必化简,空间利用率=晶胞中原子的总体积/晶胞的体积)。
(1)第二周期的元素中,I1(第一电离能)从大到小排前三位的是
(2)人类合成的第一个稀有气体化合物是XeF+PtF
 ,PtF
,PtF 中的键角有90°和180°两种。下列关于该化合物的说法中正确的是_______。
中的键角有90°和180°两种。下列关于该化合物的说法中正确的是_______。| A.熔化状态下不能导电 |
| B.XeF+中所有原子都满足8电子稳定结构 |
| C.用两个Cl替换F后,所得PtF4Cl2有两种结构 |
| D.含有离子键、极性键、非极性键和配位键 |
 溶于水可生成Xe和HPtF6,写出反应的化学方程式。
溶于水可生成Xe和HPtF6,写出反应的化学方程式。(4)解释HNO3和HNO2酸性强弱不同的原因
(5)SCN—中C原子的杂化类型为
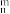 表示,n为原子数,m为电子数),检验Fe3+时,SCN—以 S原子配位不以N原子配位的原因是
表示,n为原子数,m为电子数),检验Fe3+时,SCN—以 S原子配位不以N原子配位的原因是(6)如图,在NaCl的晶体中,Na+和Cl—互相占据对方的正八面体空隙,CaF2晶体中,F—占据由Ca2+构成的所有正四面体空隙。钛镍合金具有形状记忆功能。某钛、镍原子个数比为2:1的合金的晶体结构为:镍原子呈面心立方排列,钛原子填充在由镍原子围成的所有八面体空隙和一半的四面体空隙中,若最近的钛原子和镍原子紧密接触,镍原子周围距离最近的钛原子数为

您最近一年使用:0次
名校
解题方法
2 . 银氨溶液是检验醛基的重要试剂之一。配制银氨溶液的操作是向稀硝酸银溶液中滴加稀氨水至浊液刚好变澄清,发生的反应有AgNO3+NH3·H2O=AgOH↓+NH4NO3,AgOH+2NH3=[Ag(NH3)2]++OH-。下列说法错误的是
| A.NH4NO3中N原子分别采取sp3、sp2杂化 |
| B.[Ag(NH3)2]OH中存在共价键、配位键和离子键 |
| C.NH3与H2O均是极性分子 |
| D.1mol甲醛与银氨溶液反应时最多消耗2mol[Ag(NH3)2]OH |
您最近一年使用:0次
2022-04-26更新
|
228次组卷
|
2卷引用:海南省海口市2021-2022学年高三下学期学生学科能力诊断化学试题
名校
解题方法
3 . 三氯化六氨合钴[Co(NH3)6]Cl3是一种重要的化工产品,实验室可用反应2CoCl2+ 10NH3+ 2NH4Cl+H2O2=2[Co(NH3)6]Cl+2H2O制备。下列有关说法正确的是
| A.Cl-与Co2+具有相同的电子层结构 |
| B.H2O2是非极性分子 |
C.NH3的电子式为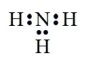 |
| D.1mol [Co(NH3)6]Cl3中含有σ键24mol |
您最近一年使用:0次
2022-04-20更新
|
342次组卷
|
4卷引用:2022年海南省高考真题变式题1-14
(已下线)2022年海南省高考真题变式题1-14江苏省南通市海门区2022届高三下学期阶段检测化学试题(已下线)化学-2022年高考押题预测卷02(江苏卷)湖南省桂东县第一中学2021-2022学年高三下学期5月月考化学试题
名校
解题方法
4 . 工业上采用还原法冶炼黄金(Au)的原理如下:
4Au+O2+8NaCN+2H2O=4Na[Au(CN)2]+4NaOH
2Na[Au(CN)2]+Zn=2Au+Na2Zn(CN)4
请回答下列问题:
(1)在元素周期表中,Au与Cu位于同族,基态Au原子比基态Cu原子多2个电子层。基态Au原子的价层电子排布式为____ ,金元素位于____ 区。
(2)Zn和Cu相邻,第一电离能:I1(Cu)____ I1(Zn)(填“>”、“<”或“=”,下同),第二电离能:I2(Cu)____ I2(Zn)。
(3)1mol[Zn(CN)4]2-中含____ molσ键。
(4)已知卤化锌的熔点如表所示:
①ZnF2晶体所属的晶体类型为____ 。
②ZnCl2,ZnBr2,ZnI2的熔点递增的主要原因是____ 。
(5)通常情况下,金属Au单独与氧气或氰化钠溶液都不能反应,但该反应4Au+O2+8NaCN+2H2O=4Na[Au(CN)2]+4NaOH能发生的原因是____ 。
(6)金晶体的晶胞结构如图,其晶胞参数为408pm,金晶体的密度为____ g•cm-3(列计算式,设NA为阿伏加德罗常数的值)。

4Au+O2+8NaCN+2H2O=4Na[Au(CN)2]+4NaOH
2Na[Au(CN)2]+Zn=2Au+Na2Zn(CN)4
请回答下列问题:
(1)在元素周期表中,Au与Cu位于同族,基态Au原子比基态Cu原子多2个电子层。基态Au原子的价层电子排布式为
(2)Zn和Cu相邻,第一电离能:I1(Cu)
(3)1mol[Zn(CN)4]2-中含
(4)已知卤化锌的熔点如表所示:
| 卤化锌 | ZnF2 | ZnCl2 | ZnBr2 | ZnI2 |
| 熔点/℃ | 872 | 283 | 394 | 446 |
②ZnCl2,ZnBr2,ZnI2的熔点递增的主要原因是
(5)通常情况下,金属Au单独与氧气或氰化钠溶液都不能反应,但该反应4Au+O2+8NaCN+2H2O=4Na[Au(CN)2]+4NaOH能发生的原因是
(6)金晶体的晶胞结构如图,其晶胞参数为408pm,金晶体的密度为

您最近一年使用:0次
5 . Ti、Na、Mg、C、N、O、Fe等元素的研究一直在进行中,其单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)下列各组多电子原子的能级能量比较不正确的是_______
①2p=3p ②4s>2s ③4p>4f ④4d>3d
(2)Fe3+与Fe2+的离子半径大小关系为Fe3+_______ Fe2+(填“大于”或“小于”)
(3)C、N、O三种元素的第一电离能有大到小的排序为_______
(4)[Ni(NH3)6]SO4中配位数为_______ ,配位原子为_______ 。
(5)1molCH3COOH分子中含有σ键的为_______ mol。
(1)下列各组多电子原子的能级能量比较不正确的是_______
①2p=3p ②4s>2s ③4p>4f ④4d>3d
| A.①④ | B.①③ | C.③④ | D.②③ |
(3)C、N、O三种元素的第一电离能有大到小的排序为
(4)[Ni(NH3)6]SO4中配位数为
(5)1molCH3COOH分子中含有σ键的为
您最近一年使用:0次
真题
名校
6 . 关于 性质的解释合理的是
性质的解释合理的是
 性质的解释合理的是
性质的解释合理的是| 选项 | 性质 | 解释 |
| A | 比 容易液化 容易液化 |  分子间的范德华力更大 分子间的范德华力更大 |
| B | NH3熔点高于 |  键的键能比 键的键能比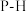 大 大 |
| C | 能与 以配位键结合 以配位键结合 |  中氮原子有孤电子对 中氮原子有孤电子对 |
| D | 氨水中存在 |  是离子化合物 是离子化合物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-10-23更新
|
5185次组卷
|
20卷引用:2021年新高考海南化学高考真题
2021年新高考海南化学高考真题2021年海南高考化学试题变式题11-19(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)河南省商丘市五校2021-2022学年高二下学期5月联考化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)河南省南阳市第六完全学校高级中学2021-2022学年高二下学期4月月考化学试题广东省华南师范大学附属中学2023届高三上学期第一次月考化学试题(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三上学期10月月考化学试题黑龙江省绥化市绥棱县第一中学2022-2023学年高三上学期10月月考化学试题广东省深圳市福田区福田中学2022-2023学年高三上学期第三次考试化学试题山东省昌乐第一中学2022-2023学年高二下学期第一次月考化学试题江苏省南京师范大学附属中学2022-2023学年高一下学期期末考试化学A卷试题(已下线)第3讲 化学键 共价键的类型及键参数(已下线)考点42 分子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第5讲 分子结构与性质上海市曹杨第二中学2023-2024学年高三上学期期中考试化学试题山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题北京市十一学校2023-2024学年高一下学期第三学段教学诊断化学试题福建省厦门市湖滨中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
7 . 二茂铁 的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
 的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是| A.二茂铁属于分子晶体 |
B.在二茂铁中, 与 与 之间形成的化学键类型是离子键 之间形成的化学键类型是离子键 |
C.已知环戊二烯的结构式为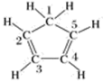 ,则其中仅有1个碳原子采取 ,则其中仅有1个碳原子采取 杂化 杂化 |
D. 中一定含有 中一定含有 键 键 |
您最近一年使用:0次
2021-10-14更新
|
1100次组卷
|
24卷引用:2020年海南卷化学高考真题变式题9-14
(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题9-142017届安徽省安庆市怀宁中学等六校高三第一次联考化学试卷2016-2017学年河南省郑州外国语学校高二下学期月考(一)化学试卷福建省安溪一中、养正中学、惠安一中、泉州实验中学2016-2017学年高二下学期期末联考化学试题第3章 物质的聚集状态与物质性质——C挑战区 模拟高考(鲁科版选修3)福建省厦门双十中学2018-2019学年高二下学期期中考试化学试题(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期第四次质量监测化学试题福建省龙岩第一中学2021-2022学年高二(实验班)下学期第一次月考化学试题湖北省武汉市第二中学2022届高三5月全仿真模拟考试(一)化学试题湖南省长沙市望城区第一中学2022届高三下学期期中考试化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题全书综合测评-苏教版选择性必修2第三章 本章达标检测2山西省太原市英才学校2021-2022学年高二下学期线上期中化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期末考试化学试题河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题山东省昌乐第一中学2022-2023学年高二下学期第一次月考化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次大单元考试化学试题福建省莆田第二十五中学2023-2024学年高二下学期第一次质量检化学试题
名校
8 . Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,下列说法正确的是
| A.此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为O>N>C |
B.配合物K4Fe(CN)6的中心离子的价电子排布图为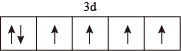 ,该中心离子的配位数是10 ,该中心离子的配位数是10 |
| C.1mol HCN分子中含有σ键的数目为 1.204×1024,HCN分子中碳原子轨道杂化类型是 sp杂化 |
| D.K2CO3中阴离子的空间构型为三角锥形,其中碳原子的价层电子对数为4 |
您最近一年使用:0次
2021-09-29更新
|
438次组卷
|
6卷引用:2020年海南卷化学高考真题变式题9-14
(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题9-14河南省辉县市一中2020-2021学年高二(培优班)下学期第二次阶段性考试化学试题宁夏石嘴山市平罗中学2022-2023学年高二上学期期中考试(重点班)化学试题湖南省攸县第一中学2022-2023学年高二上学期期末考试化学试题山东省潍坊市安丘市潍坊国开中学2023-2024学年高二下学期3月月考化学试题
名校
9 . 下列说法中正确的是
| A.过氧化钠的电子式是 Na+[:O:O:]2-Na+ |
| B.原子最外层电子排布式为4s1和5s1 是同一主族元素 |
| C.电负性差值大于 1.7 的化合物一定是离子化合物 |
| D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是H2O,配位数是 4 |
您最近一年使用:0次
解题方法
10 . 锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)基态Cu2+的核外电子排布式为_______________________ 。
(2)根据价层电子对互斥模型(VSEPR),PO43-离子内中心原子价层成键电子对和孤电子对之和为_______ ,离子的空间构型是_________________________ 。
(3)液氨分子间存在自耦电离:2NH3⇌ NH2-+NH4+,NH2-中氮原子轨道的杂化类型是___________ ,H+易与NH3形成NH4+,配位键的解释是_______________ 。
(4)胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有_____________ 。(填序号)
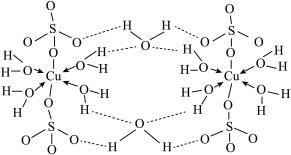
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,Cu2+的配位数为______ ,1mol CN-中含有的π键的数目为_________ 。
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)基态Cu2+的核外电子排布式为
(2)根据价层电子对互斥模型(VSEPR),PO43-离子内中心原子价层成键电子对和孤电子对之和为
(3)液氨分子间存在自耦电离:2NH3⇌ NH2-+NH4+,NH2-中氮原子轨道的杂化类型是
(4)胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有

a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,Cu2+的配位数为
您最近一年使用:0次



