1 . 铁、铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为___________ 。
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。在蒸气中也容易双聚,据此判断三氯化铁晶体为___________ (填“分子晶体”或“离子晶体”)。
(3)(NH4)2Fe(SO4)2∙6H2O俗称摩尔盐,其阴离子 的空间构型为
的空间构型为___________ 。
(4)Fe(CO)5可用作催化剂、汽油抗爆剂等,其分子中σ键和π键的数目之比为___________ 。CO的沸点高于N2的原因是___________ 。
(5)CuCl2和CuCl是铜的两种氯化物。
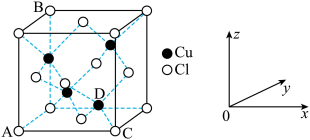
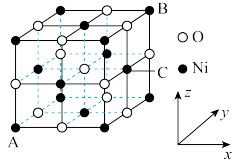
①图中表示的是___________ (填“CuCl2”或“CuCl”)的晶胞。
②原子坐标参数可用来表示晶胞内各原子的相对位置,图中各原子坐标参数A为 (0,0,0);B为(0,1,1);C为(1,0,0);则D原子的坐标参数为___________ 。
(1)基态Fe原子的价层电子的电子排布图为
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。在蒸气中也容易双聚,据此判断三氯化铁晶体为
(3)(NH4)2Fe(SO4)2∙6H2O俗称摩尔盐,其阴离子
 的空间构型为
的空间构型为(4)Fe(CO)5可用作催化剂、汽油抗爆剂等,其分子中σ键和π键的数目之比为
(5)CuCl2和CuCl是铜的两种氯化物。

①图中表示的是
②原子坐标参数可用来表示晶胞内各原子的相对位置,图中各原子坐标参数A为 (0,0,0);B为(0,1,1);C为(1,0,0);则D原子的坐标参数为
您最近一年使用:0次
名校
解题方法
2 . 钛、铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)基态钴原子的价层电子排布式为___________ ,铁、钴、镍的基态原子核外未成对电子数最少的是___________ (填元素名称)。
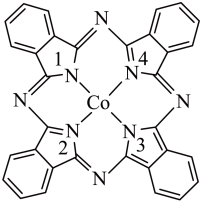
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞菁钴分子中与钴离子通过配位键结合的氮原子的编号是___________ ;酞菁钴分子中所含三种非金属元素的电负性由大到小的顺序为___________ (用相应的元素符号表示);碳原子的杂化轨道类型为___________ 。
(3)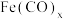 ,常温下呈液态,熔点为
,常温下呈液态,熔点为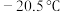 。沸点为103℃。易溶于非极性溶剂,据此可判断
。沸点为103℃。易溶于非极性溶剂,据此可判断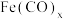 晶体属于
晶体属于___________ (填晶体类型),若配合物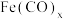 的中心原子价电子数与配体提供电子数之和为18,则
的中心原子价电子数与配体提供电子数之和为18,则
___________ 。
(4)在相同条件下。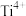 比
比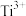 的水解能力更强,原因是
的水解能力更强,原因是___________ 。
(1)基态钴原子的价层电子排布式为
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞菁钴分子中与钴离子通过配位键结合的氮原子的编号是

(3)
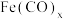 ,常温下呈液态,熔点为
,常温下呈液态,熔点为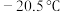 。沸点为103℃。易溶于非极性溶剂,据此可判断
。沸点为103℃。易溶于非极性溶剂,据此可判断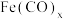 晶体属于
晶体属于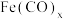 的中心原子价电子数与配体提供电子数之和为18,则
的中心原子价电子数与配体提供电子数之和为18,则
(4)在相同条件下。
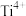 比
比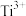 的水解能力更强,原因是
的水解能力更强,原因是
您最近一年使用:0次
名校
解题方法
3 . 下列关于物质的结构与性质描述错误的是
| A.石英的熔点、硬度比金刚石的小 |
B. 分子中存在非极性共价键 分子中存在非极性共价键 |
C.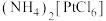 既含有离子键又含有共价键 既含有离子键又含有共价键 |
D. 的熔点比 的熔点比 的高,因为氨分子间存在氢键 的高,因为氨分子间存在氢键 |
您最近一年使用:0次
2024-01-22更新
|
656次组卷
|
4卷引用:海南省农垦中学2023-2024学年高二下学期期中考试化学试题
海南省农垦中学2023-2024学年高二下学期期中考试化学试题2024年1月甘肃普通高等学校招生考试适应性测试化学试题(已下线)选择题6-10(已下线)专题04 物质结构与性质-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
4 . 二氯化一氯五氨合钴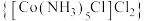 可用作聚氯乙烯的染色剂和稳定剂。已知:
可用作聚氯乙烯的染色剂和稳定剂。已知: 不溶于水和乙醇;
不溶于水和乙醇; 是粉红色不溶于水的固体;
是粉红色不溶于水的固体; 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。
Ⅰ.制备
某实验小组利用以下装置和流程制备 。
。
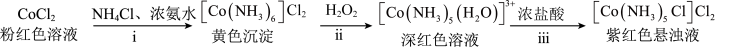
(1)步骤ⅱ,滴入 5%
5% ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(2)步骤ⅲ,待溶液中停止产生气泡后,缓慢加入 浓盐酸,在85℃水浴中加热
浓盐酸,在85℃水浴中加热 ,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。洗涤过程需要用到冰水和无水乙醇,使用无水乙醇的原因
,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。洗涤过程需要用到冰水和无水乙醇,使用无水乙醇的原因___________ 。
Ⅱ.产品结构分析
(3) 中存在的化学键有
中存在的化学键有___________ (填标号)。
a.离子键 b.范德华力 c.非极性共价键 d.极性共价键 e.配位键 f.氢键
(4) 中含
中含 键的数目为
键的数目为___________ 。
Ⅲ.实验探究
(5)实验小组在制备过程中发现 溶液中直接加入
溶液中直接加入 ,
, 不被氧化,据此认为加入浓氨水和氯化铵对
不被氧化,据此认为加入浓氨水和氯化铵对 的氧化产生了影响,提出以下猜想并设计实验验证。
的氧化产生了影响,提出以下猜想并设计实验验证。
猜想1:加入氯化铵溶液,增强了 的氧化性。
的氧化性。
猜想2:加入浓氨水形成配合物,增强了 离子的还原性。
离子的还原性。
实验结论:猜想1不合理,猜想2合理。
①a是___________ ,b是___________ 。
②步骤ⅰ中氯化铵的作用是___________ 。
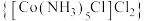 可用作聚氯乙烯的染色剂和稳定剂。已知:
可用作聚氯乙烯的染色剂和稳定剂。已知: 不溶于水和乙醇;
不溶于水和乙醇; 是粉红色不溶于水的固体;
是粉红色不溶于水的固体; 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。Ⅰ.制备

某实验小组利用以下装置和流程制备
 。
。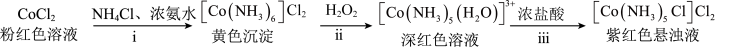
(1)步骤ⅱ,滴入
 5%
5% ,发生反应的离子方程式为
,发生反应的离子方程式为(2)步骤ⅲ,待溶液中停止产生气泡后,缓慢加入
 浓盐酸,在85℃水浴中加热
浓盐酸,在85℃水浴中加热 ,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。洗涤过程需要用到冰水和无水乙醇,使用无水乙醇的原因
,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。洗涤过程需要用到冰水和无水乙醇,使用无水乙醇的原因Ⅱ.产品结构分析
(3)
 中存在的化学键有
中存在的化学键有a.离子键 b.范德华力 c.非极性共价键 d.极性共价键 e.配位键 f.氢键
(4)
 中含
中含 键的数目为
键的数目为Ⅲ.实验探究
(5)实验小组在制备过程中发现
 溶液中直接加入
溶液中直接加入 ,
, 不被氧化,据此认为加入浓氨水和氯化铵对
不被氧化,据此认为加入浓氨水和氯化铵对 的氧化产生了影响,提出以下猜想并设计实验验证。
的氧化产生了影响,提出以下猜想并设计实验验证。猜想1:加入氯化铵溶液,增强了
 的氧化性。
的氧化性。猜想2:加入浓氨水形成配合物,增强了
 离子的还原性。
离子的还原性。
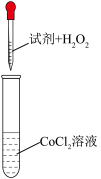
| 实验编号 | 试剂 | 现象 |
| 1 |  水 水 | 无明显变化 |
| 2 | a | 无明显变化 |
| 3 | b | 溶液变为深红色,且出现棕褐色沉淀 |
①a是
②步骤ⅰ中氯化铵的作用是
您最近一年使用:0次
2023-12-12更新
|
446次组卷
|
3卷引用:海南省海南中学2023-2024学年高三上学期第三次月考化学试题
海南省海南中学2023-2024学年高三上学期第三次月考化学试题(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)重庆市万州第二高级中学2023-2024学年高二下学期3月月考化学试题
5 . 物质的结构决定其性质。下列实例与解释不相符的是
| 选项 | 实例 | 解释 |
| A | 用 替代 替代 填充探空气球更安全 填充探空气球更安全 |  的电子构型稳定,不易得失电子 的电子构型稳定,不易得失电子 |
| B |  与 与 形成配合物 形成配合物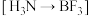 |  中的B有空轨道接受 中的B有空轨道接受 中N的孤电子对 中N的孤电子对 |
| C | 碱金属中 的熔点最高 的熔点最高 | 碱金属中 的价电子数最少,金属键最强 的价电子数最少,金属键最强 |
| D | 不存在稳定的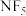 分子 分子 | N原子价层只有4个原子轨道,不能形成5个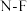 键 键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-29更新
|
4196次组卷
|
10卷引用:海南省海南中学2023-2024学年高三上学期第5次月考化学试题
海南省海南中学2023-2024学年高三上学期第5次月考化学试题河北省衡水市武邑中学2023-2024学年高三上学期12月期中考试化学试题河南省信阳高级中学2023-2024学年高三上学期1月月考理综试题江西省宜春市丰城市第九中学2023-2024学年高三上学期12月月考化学试题(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题河北省石家庄市第十七中学2023-2024高二上学期期末考试化学试题2023年河北省高考化学试卷山东省德州市夏津县第一中学2023-2024学年高二下学期3月月考化学试题(已下线)选择题6-10
真题
名校
6 . 闭花耳草是海南传统药材,具有消炎功效。车叶草苷酸是其活性成分之一,结构简式如图所示。下列有关车叶草苷酸说法正确的是


| A.分子中含有平面环状结构 |
| B.分子中含有5个手性碳原子 |
| C.其钠盐在水中的溶解度小于在甲苯中的溶解度 |
| D.其在弱碱介质中可与某些过渡金属离子形成配合物 |
您最近一年使用:0次
2023-08-03更新
|
5937次组卷
|
7卷引用:2023年高考海南卷化学真题
2023年高考海南卷化学真题(已下线)不定项选择题江西省吉安市吉州区部分学校联考2022-2023学年高二下学期期末考试化学试题山东省淄博实验中学2023-2024学年高三上学期开学考试化学试题江西省宜春市宜丰中学创新部2023-2024学年高三上学期期中考试化学试题山东省德州市第一中学2023-2024学年高三上学期1月月考化学试题(已下线)题型09 有机物的结构与性质-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
7 . 完成下列问题。
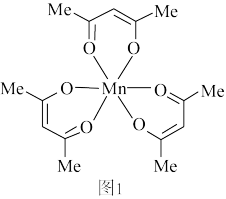
(1)乙酰丙酮锰(Ⅲ)是一种广泛用于苯酚类化合物氧化偶联的试剂,中心离子为Mn3+离子,其结构如图1所示,图中Me表示—CH3___________ ,1mol乙酰丙酮锰(Ⅲ)中含有σ键的数目为___________ (NA表示阿伏伽德罗常数),该结构中碳原子的VSEPR模型为___________ 。若中心离子含有单电子,则配合物为顺磁性物质,则乙酰丙酮锰(Ⅲ)___________ 顺磁性(填“有”或“无”)。
(2)石墨晶体如图(a)所示,图(b)为石墨的六方晶胞。___________ (用“●”标出碳原子位置即可)。___________ 。___________ 。Ni2+的配位数为___________ 。实际氧化镍晶体中存在缺陷,随机缺失部分Ni2+,化学式为Ni0.88O。设实际晶胞边长为apm,阿伏伽德罗常数为NA,写出实际晶体密度计算表达式:___________ g/cm3。
(1)乙酰丙酮锰(Ⅲ)是一种广泛用于苯酚类化合物氧化偶联的试剂,中心离子为Mn3+离子,其结构如图1所示,图中Me表示—CH3
(2)石墨晶体如图(a)所示,图(b)为石墨的六方晶胞。
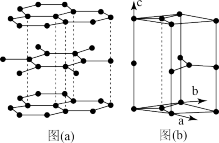

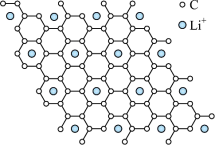
您最近一年使用:0次
名校
解题方法
8 . 某小组同学探究FeCl3溶液显黄色的原因。
资料:i.FeCl3溶液中存在平衡:[Fe(H2O)6]3++H2O⇌[Fe(H2O)5]2++H3O+
ii.Fe3+与 不能形成配位键。
不能形成配位键。
(1)Fe3+的核外电子排布式为___________ 。
[猜想与预测]
小组同学认为可能是Fe3+与其他微粒配位形成的配离子导致溶液显黄色,进而提出以下猜想:
Ⅰ.Fe3+与OH-配位 Ⅱ.Fe3+与H2O配位 Ⅲ.Fe3+与Cl-配位
(2)解释Fe3+可与这些微粒形成配合物的原因:___________ 。
[实验与分析]
为验证猜想I,小组同学设计并完成了以下实验。
(3)实验a的作用是___________ 。
(4)①甲同学认为实验c可以证明猜想Ⅰ成立,而猜想Ⅱ不成立,理由是___________ 。小组同学为了证明猜想Ⅲ成立,将实验c所得溶液分为两份进行了如下实验:
②实验d的实验现象为___________ ,证明猜想Ⅲ成立
[结论与反思]
(5)依据上述现象解释FeCl3溶液显黄色的原因是___________ 。
(6)已知EDTA与Fe3+配位能力比SCN-更强,设计实验证明Fe3+与EDTA形成的配合物为浅黄色(EDTA通常配成溶液使用):___________ 。
资料:i.FeCl3溶液中存在平衡:[Fe(H2O)6]3++H2O⇌[Fe(H2O)5]2++H3O+
ii.Fe3+与
 不能形成配位键。
不能形成配位键。(1)Fe3+的核外电子排布式为
[猜想与预测]
小组同学认为可能是Fe3+与其他微粒配位形成的配离子导致溶液显黄色,进而提出以下猜想:
Ⅰ.Fe3+与OH-配位 Ⅱ.Fe3+与H2O配位 Ⅲ.Fe3+与Cl-配位
(2)解释Fe3+可与这些微粒形成配合物的原因:
[实验与分析]
为验证猜想I,小组同学设计并完成了以下实验。
| 实验 | a | b | c |
| 实验操作 |  |  | 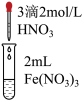 |
| 实验现象 | 溶液黄色略变浅 | 溶液黄色略变浅 | 黄色褪去 |
(4)①甲同学认为实验c可以证明猜想Ⅰ成立,而猜想Ⅱ不成立,理由是
| 实验 | d | e |
| 实验操作 | 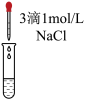 |  |
| 实验现象 | _______ | 溶液仍为无色 |
[结论与反思]
(5)依据上述现象解释FeCl3溶液显黄色的原因是
(6)已知EDTA与Fe3+配位能力比SCN-更强,设计实验证明Fe3+与EDTA形成的配合物为浅黄色(EDTA通常配成溶液使用):
您最近一年使用:0次
名校
9 . 二茂铁的发现开启了金属有机化学的新时代。二茂铁是由环戊二烯阴离子(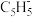 )与Fe2+形成的分子,
)与Fe2+形成的分子,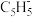 和二茂铁的结构如图1所示。回答下列问题:
和二茂铁的结构如图1所示。回答下列问题:

(1)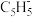 是平面结构,其C原子的杂化方式为
是平面结构,其C原子的杂化方式为___________ 。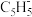 中存在类似于石墨层中的大π键,可用符号
中存在类似于石墨层中的大π键,可用符号 表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。如苯分子中的大π键可表示为
表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。如苯分子中的大π键可表示为 ,则
,则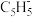 中的大π键应表示为
中的大π键应表示为___________ 。
(2)二茂铁晶体可能具有的性质有:___________ 。(填序号)
a.熔沸点高 b.熔沸点低 c.易溶于水 d.易溶于苯等有机溶剂
(3)理想状态下,固态二茂铁为交错结构,气态为重叠结构,如图2所示:
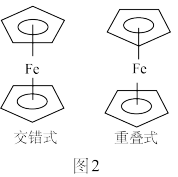
已知二茂铁的相关数据:
实际上气态二茂铁中仍有相当一部分为交错结构,其原因是___________ 。
(4)二茂铅的结构如图3所示,分子中两个二茂环不平行,原因是___________ 。
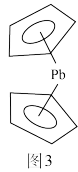
(5)Fe2+形成的另一种常见晶体为绿矾(FeSO4·7H2O),结构如图所示:
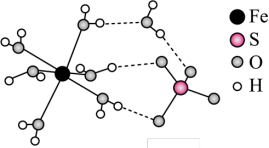
该晶体中存在的化学键类型有___________ 。
a.范德华力 b.氢键 c.配位键 d.离子键 e.非极性键 f.极性键
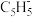 )与Fe2+形成的分子,
)与Fe2+形成的分子,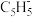 和二茂铁的结构如图1所示。回答下列问题:
和二茂铁的结构如图1所示。回答下列问题:
(1)
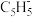 是平面结构,其C原子的杂化方式为
是平面结构,其C原子的杂化方式为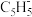 中存在类似于石墨层中的大π键,可用符号
中存在类似于石墨层中的大π键,可用符号 表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。如苯分子中的大π键可表示为
表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。如苯分子中的大π键可表示为 ,则
,则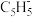 中的大π键应表示为
中的大π键应表示为(2)二茂铁晶体可能具有的性质有:
a.熔沸点高 b.熔沸点低 c.易溶于水 d.易溶于苯等有机溶剂
(3)理想状态下,固态二茂铁为交错结构,气态为重叠结构,如图2所示:

已知二茂铁的相关数据:
| 旋转势垒 | 升华热 |
| 3.8kJ·mol1 | 68.2kJ·mol1 |
(4)二茂铅的结构如图3所示,分子中两个二茂环不平行,原因是
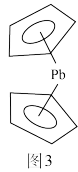
(5)Fe2+形成的另一种常见晶体为绿矾(FeSO4·7H2O),结构如图所示:

该晶体中存在的化学键类型有
a.范德华力 b.氢键 c.配位键 d.离子键 e.非极性键 f.极性键
您最近一年使用:0次
名校
10 . 用H2O2氧化[Co(NH3)6]2+可得[Co(NH3)6]3+,其空间结构如图。其中1~6处的小圆圈表示NH3分子,相邻NH3分子的距离相等,中心离子Co3+位于八面体的中心,NH3分子到Co3+的距离相等(图中虚线长度相等),下列说法错误的是
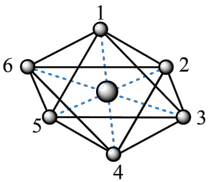

| A.H2O2为非极性分子 |
| B.NH3、H2O与Co3+形成配离子的稳定性:NH3>H2O |
| C.NH3与Co3+配位之后,∠H-N-H会变小 |
| D.若[Co(NH3)6]3+中两个NH3被Cl-替代,得到的[Co(NH3)4Cl2]+有2种结构 |
您最近一年使用:0次



