名校
1 . 冰晶石(Ng3AlF6)是电解铝工业的助熔剂、制造乳白色玻璃和搪瓷的遮光剂。制取冰晶石的反应为 ,下列有关化学用语表示正确的是
,下列有关化学用语表示正确的是
 ,下列有关化学用语表示正确的是
,下列有关化学用语表示正确的是A.基态Al原子的价层电子轨道表示式: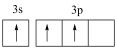 |
B.CO2的电子式: |
C.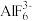 的结构式: 的结构式: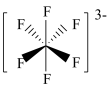 |
D. 的VSEPR模型: 的VSEPR模型: |
您最近一年使用:0次
解题方法
2 . 锂离子电池是近年来的研究热点,常见的锂离子聚合物电池材料有石墨、 、
、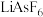 、
、 等。请回答:
等。请回答:
(1) 的阴离子的空间构型为
的阴离子的空间构型为_______ 。
(2)下列说法正确的是_______。
(3)一种类石墨的聚合物g- 可由三聚氰胺(
可由三聚氰胺( )制得,合成三聚氰胺的单体结构简式是
)制得,合成三聚氰胺的单体结构简式是_______ 。三聚氰胺分子不溶于冷水,溶于热水,主要原因是______________ 。
(4)尖晶石结构的 (x、y为整数)是一种常用的正极材料。已知
(x、y为整数)是一种常用的正极材料。已知 晶胞可看成由A、B单元按Ⅲ方式交替排布构成,“
晶胞可看成由A、B单元按Ⅲ方式交替排布构成,“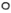 ”表示
”表示 。
。_______ ,若该晶胞的晶胞参数为a pm,则该晶体的密度为_______  (列出计算表达式,不必化简。
(列出计算表达式,不必化简。 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、
、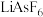 、
、 等。请回答:
等。请回答:(1)
 的阴离子的空间构型为
的阴离子的空间构型为(2)下列说法正确的是_______。
A.离子半径: |
B.基态As的最高能级的电子排布式为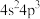 |
C.与 形成配位键的能力: 形成配位键的能力: |
| D.电负性:F>O>As>P |
(3)一种类石墨的聚合物g-
 可由三聚氰胺(
可由三聚氰胺( )制得,合成三聚氰胺的单体结构简式是
)制得,合成三聚氰胺的单体结构简式是(4)尖晶石结构的
 (x、y为整数)是一种常用的正极材料。已知
(x、y为整数)是一种常用的正极材料。已知 晶胞可看成由A、B单元按Ⅲ方式交替排布构成,“
晶胞可看成由A、B单元按Ⅲ方式交替排布构成,“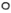 ”表示
”表示 。
。
 (列出计算表达式,不必化简。
(列出计算表达式,不必化简。 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
3 . 根据实验目的设计方案并进行实验,下列有关方案设计、实验现象或结论都正确的是
| 实验目的 | 方案设计 | 现象 | 结论 | |
| A | 比较Cu和Fe的金属性强弱 | 取同浓度的① 、② 、② 溶液,滴加同浓度氨水 溶液,滴加同浓度氨水 | ①先沉淀后溶解,②沉淀后不溶解 | 金属性:Cu<Fe |
| B | 检验己烯中的碳碳双键 | 取少量己烯,加入溴的四氯化碳溶液,振荡 | 上下两层均无色 | 己烯中含碳碳双键 |
| C | 比较配离子的稳定性 | 向盛有少量蒸馏水的试管里加2滴 ,然后再加2滴硫氰化钾溶液 ,然后再加2滴硫氰化钾溶液 | 溶液由黄色变血红色 |  与 与 形成的配离子更稳定 形成的配离子更稳定 |
| D | 比较温度对反应速率的影响 | 将2mL 0.1mol/L  溶液(A)浸入0℃水浴中、2mL 0.05mol/L 溶液(A)浸入0℃水浴中、2mL 0.05mol/L  溶液(B)浸入50℃水浴中,再同时滴加0.1mol/L稀硫酸2mL 溶液(B)浸入50℃水浴中,再同时滴加0.1mol/L稀硫酸2mL | B溶液比A溶液先出现浑浊 | 温度越高,反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 中国科学院化学所通过向 溶液引入ppm量级Cu离子,改善了光电阳极上氨催化反应的性能。其可能的反应历程如下图所示。下列说法错误的是
溶液引入ppm量级Cu离子,改善了光电阳极上氨催化反应的性能。其可能的反应历程如下图所示。下列说法错误的是
 溶液引入ppm量级Cu离子,改善了光电阳极上氨催化反应的性能。其可能的反应历程如下图所示。下列说法错误的是
溶液引入ppm量级Cu离子,改善了光电阳极上氨催化反应的性能。其可能的反应历程如下图所示。下列说法错误的是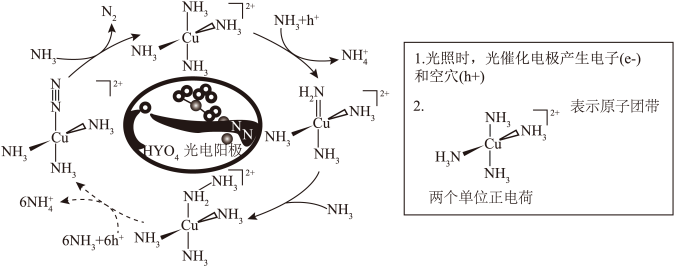
A.氨催化反应的光电阳极反应方程式为: |
B.配离子 比 比 更稳定 更稳定 |
C.反应历程中有 键、 键、 键的断裂和形成 键的断裂和形成 |
D. 中 中 的键角大于 的键角大于 中 中 的键角 的键角 |
您最近一年使用:0次
5 . 锌是一种重要的金属,锌及其化合物被广泛应用于汽车、建筑、船舶、电池等行业。现某科研小组以固体废锌催化剂(主要成分是 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示:
①“浸取”时, 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。
② 时,
时, ,
, 。
。
③深度除杂标准:溶液中 ≤2.0×10-6。
≤2.0×10-6。
(1)“浸取”温度为 ,锌的浸出率可达
,锌的浸出率可达 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为___________ 。
(2)“滤渣1”的主要成分为 、
、___________ 。
(3)“深度除锰”是将残留的 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式___________ 。
(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比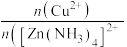 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。
①当 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是___________ (用离子方程式解释)。
②“深度除铜”时 加入量最优选择
加入量最优选择___________ (填标号)。
A.100% B.110% C.120% D.130%
(5) 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图:___________ 。
②基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示: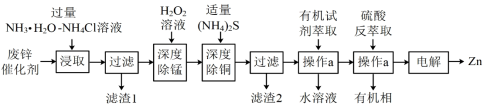
①“浸取”时,
 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。②
 时,
时, ,
, 。
。③深度除杂标准:溶液中
 ≤2.0×10-6。
≤2.0×10-6。(1)“浸取”温度为
 ,锌的浸出率可达
,锌的浸出率可达 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为(2)“滤渣1”的主要成分为
 、
、(3)“深度除锰”是将残留的
 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比
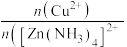 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。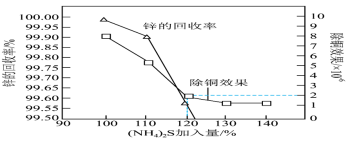
①当
 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是②“深度除铜”时
 加入量最优选择
加入量最优选择A.100% B.110% C.120% D.130%
(5)
 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图:
②基态
 原子的价电子排布式为
原子的价电子排布式为
您最近一年使用:0次
名校
解题方法
6 . 蓝铜矿的主要成分为2CuCO3·Ca(OH)2,将它与焦炭一起加热可以生成Cu、CO2和H2O。下列说法正确的是
| A.Cu是第四周期第ⅦB族元素 |
| B.0.1mol[Cu(H2O)4]2+中所含配位键的物质的量为0.8mol |
| C.电负性:O>C>H |
| D.将0.1L0.1mol/L[Cu(NH3)4](OH)2加入足量的MgCl2溶液中,理论上可得到0.2molMg(OH)2 |
您最近一年使用:0次
名校
解题方法
7 . X、Y、Z、M、R、Q为六种短周期元素,其原子半径和最外层电子数之间的关系如图所示,下列说法正确的是
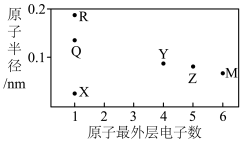
| A.M存在最高化合价为+6价 |
| B.Q单质与Y的氧化物之间一定无法发生置换反应 |
C.Y、M形成的化合物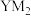 为大气污染物 为大气污染物 |
| D.X、Z、M可形成一种含共价键、配位键的离子化合物 |
您最近一年使用:0次
今日更新
|
380次组卷
|
2卷引用:广东省汕头市2024届高三二模考试化学试
名校
解题方法
8 . 能在水中捕获阴离子的分子受体在生物医学、工业等方面具有巨大应用。某水相受体(分子笼c)能识别 ,其合成过程如下:
,其合成过程如下:
 ,其合成过程如下:
,其合成过程如下: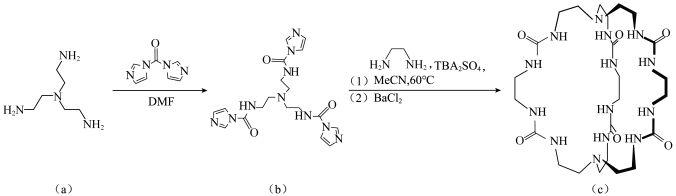
| A.物质(a)、(b)中N原子的杂化方式相同 |
| B.分子笼c能与水分子间形成氢键 |
C. 和 和 的空间构型都为正四面体 的空间构型都为正四面体 |
D.分子笼c与 间的作用为配位键 间的作用为配位键 |
您最近一年使用:0次
9 . 有一种有超导性的硼镁化合物,其晶体结构、晶胞沿c轴的投影图如图所示,已知在投影图中,B位于三个Mg形成的正三角形的中心,阿伏加德罗常数值为NA,图中长度单位均为厘米,关于其晶体下列说法正确的是
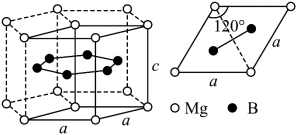
| A.该化合物的化学式为Mg3B2 |
| B.该晶体中Mg的配位数为8 |
| C.每个B原子周围都有2个与之等距离且最近的B原子 |
D.该晶体的密度为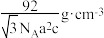 |
您最近一年使用:0次
10 . 结构决定性质是化学的基本原理,结构的细微差异会导致物质化学性质变化。回答下列问题:
(1) 是一种离子晶体,其中Au的化合价为
是一种离子晶体,其中Au的化合价为 ,晶体中的阳离子的离子符号为
,晶体中的阳离子的离子符号为______ ; 低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为
低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为______ 。金元素形成的部分离子氧化性很强,与“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是______ (填序号)。
A. B.
B. C.
C. D.
D.
(2)吡咯( )具有芳香性,分子中存在大
)具有芳香性,分子中存在大 键,1 mol吡咯分子中
键,1 mol吡咯分子中 键数目为
键数目为______ 。用氧原子(或硫原子)替代吡咯中的氮原子可以得到呋喃(或噻吩分子),则呋喃分子的键线式为______ ;分子结构中的大 键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因
键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因______ 。
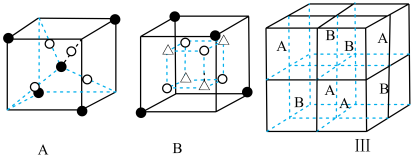
(3)将钴氧化物和 按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。
按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。 的比例为
的比例为______ ;
②图乙所示字母中,Ⅰ型小立方体分别是a、______ (填字母符号)。
(1)
 是一种离子晶体,其中Au的化合价为
是一种离子晶体,其中Au的化合价为 ,晶体中的阳离子的离子符号为
,晶体中的阳离子的离子符号为 低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为
低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为A.
 B.
B. C.
C. D.
D.
(2)吡咯(
 )具有芳香性,分子中存在大
)具有芳香性,分子中存在大 键,1 mol吡咯分子中
键,1 mol吡咯分子中 键数目为
键数目为 键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因
键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因(3)将钴氧化物和
 按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。
按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。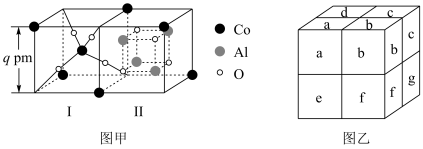
 的比例为
的比例为②图乙所示字母中,Ⅰ型小立方体分别是a、
您最近一年使用:0次



