1 . 锌是一种重要的金属,锌及其化合物被广泛应用于汽车、建筑、船舶、电池等行业。某科研小组以固体废锌催化剂(主要成分为 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示: 、
、 分别转化为
分别转化为 、
、 进入溶液。
进入溶液。
② 时,
时,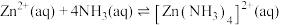

③ 时,
时,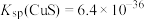 ,
,
请回答下列问题:
(1) 在元素周期表中位于
在元素周期表中位于___________ 区。
(2)“浸取”温度为 时,锌的浸出率可达
时,锌的浸出率可达 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为___________ 。
(3)“深度除锰”是将残留的 转化为
转化为 ,写出该过程的离子方程式:
,写出该过程的离子方程式:___________ 。
(4)“深度除铜”时,若加入的 过量,会发生反应
过量,会发生反应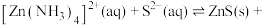
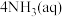 ,导致锌的回收率下降,该反应的平衡常数数值为
,导致锌的回收率下降,该反应的平衡常数数值为___________ 。
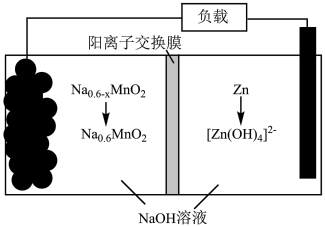
(5)“电解”产物可用于 双离子电池中(装置如图所示)。该电池工作时,正极上发生的电极反应式为
双离子电池中(装置如图所示)。该电池工作时,正极上发生的电极反应式为___________ ;每转移 电子,负极区电解质溶液的质量增加
电子,负极区电解质溶液的质量增加___________  。
。 原子能形成多种配合物,一种锌的配合物的结构如图所示:
原子能形成多种配合物,一种锌的配合物的结构如图所示:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②配位键 和
和 相比,较稳定的是
相比,较稳定的是___________ (填“ ”或“
”或“ ”),其原因是
”),其原因是___________ 。
 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示:
 、
、 分别转化为
分别转化为 、
、 进入溶液。
进入溶液。②
 时,
时,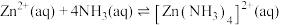

③
 时,
时,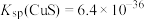 ,
,
请回答下列问题:
(1)
 在元素周期表中位于
在元素周期表中位于(2)“浸取”温度为
 时,锌的浸出率可达
时,锌的浸出率可达 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为(3)“深度除锰”是将残留的
 转化为
转化为 ,写出该过程的离子方程式:
,写出该过程的离子方程式:(4)“深度除铜”时,若加入的
 过量,会发生反应
过量,会发生反应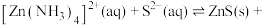
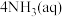 ,导致锌的回收率下降,该反应的平衡常数数值为
,导致锌的回收率下降,该反应的平衡常数数值为(5)“电解”产物可用于
 双离子电池中(装置如图所示)。该电池工作时,正极上发生的电极反应式为
双离子电池中(装置如图所示)。该电池工作时,正极上发生的电极反应式为 电子,负极区电解质溶液的质量增加
电子,负极区电解质溶液的质量增加 。
。
 原子能形成多种配合物,一种锌的配合物的结构如图所示:
原子能形成多种配合物,一种锌的配合物的结构如图所示:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②配位键
 和
和 相比,较稳定的是
相比,较稳定的是 ”或“
”或“ ”),其原因是
”),其原因是
您最近一年使用:0次
名校
解题方法
2 . 实验室制备配合物 的原理是
的原理是
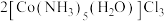 ,下列叙述错误的是
,下列叙述错误的是
 的原理是
的原理是
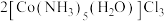 ,下列叙述错误的是
,下列叙述错误的是A. 的电子式为 的电子式为 |
B.基态N原子价层电子排布图为 |
C. 中 中 的配位数为6 的配位数为6 |
D.已知 为正八面体结构,则 为正八面体结构,则 有4种结构 有4种结构 |
您最近一年使用:0次
3 . 工业上,从铜镍矿(主要成分为铜氧化物、镍氧化物,含有 、
、 、
、 等杂质)中提取镍和铜的一种工艺流程如下:
等杂质)中提取镍和铜的一种工艺流程如下:
②当溶液中某离子浓度c≤10-5mol/L时,可认为该离子沉淀完全。
③
(1)基态 原子的价电子排布图为
原子的价电子排布图为___________ 。
(2)浸出过程中通入 的目的是
的目的是___________ 。
(3)萃取时发生反应: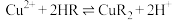 (HR、CuR2在有机层,
(HR、CuR2在有机层, 在水层)。
在水层)。___________ 。
(4)写出用惰性电极电解 溶液发生反应的化学方程式:
溶液发生反应的化学方程式:___________ 。
(5)黄钠铁矾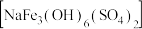 比
比 更易形成沉淀,则生成黄钠铁矾的离子方程式是
更易形成沉淀,则生成黄钠铁矾的离子方程式是___________ 。
(6)第二次使用 调节溶液
调节溶液 ,使
,使 沉淀完全,应将
沉淀完全,应将 调节至
调节至___________ (保留2位小数)。
 、
、 、
、 等杂质)中提取镍和铜的一种工艺流程如下:
等杂质)中提取镍和铜的一种工艺流程如下: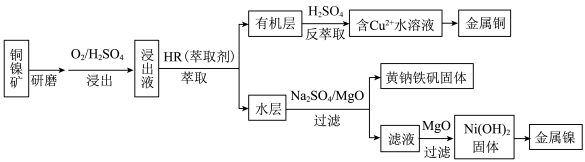
| 物质 |  |  |  |  |
 |  |  |  | 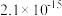 |
③

(1)基态
 原子的价电子排布图为
原子的价电子排布图为(2)浸出过程中通入
 的目的是
的目的是(3)萃取时发生反应:
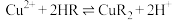 (HR、CuR2在有机层,
(HR、CuR2在有机层, 在水层)。
在水层)。①某种 的结构简式为
的结构简式为 ,该分子中可能与
,该分子中可能与 形成配位键的原子有
形成配位键的原子有
(4)写出用惰性电极电解
 溶液发生反应的化学方程式:
溶液发生反应的化学方程式:(5)黄钠铁矾
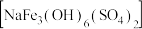 比
比 更易形成沉淀,则生成黄钠铁矾的离子方程式是
更易形成沉淀,则生成黄钠铁矾的离子方程式是(6)第二次使用
 调节溶液
调节溶液 ,使
,使 沉淀完全,应将
沉淀完全,应将 调节至
调节至
您最近一年使用:0次
解题方法
4 . 下列物质性质和原理分析相匹配的是
| 选项 | 物质性质 | 原理分析 |
| A | 超分子冠醚能识别钾离子 | 超分子具有自组装的特征 |
| B | 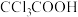 的酸性比 的酸性比 的强 的强 | 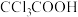 的摩尔质量大于 的摩尔质量大于 |
| C | 甲酸的沸点高于二甲醚( ) ) | 甲酸的范德华力大于二甲醚 |
| D | 冰醋酸不导电,醋酸溶液能导电 | 冰醋酸中没有能自由移动的离子,醋酸溶液中有能自由移动的离子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 下列有关物质结构与性质的说法错误的是
A. 比 比 稳定,是由于 稳定,是由于 分子间存在氢键,而 分子间存在氢键,而 分子间不存在氢键 分子间不存在氢键 |
| B.Zn的第一电离能大于Ga,是由于Zn的价层电子排布是全充满的,比较稳定 |
C. 溶于氨水,是由于 溶于氨水,是由于 与 与 反应生成了可溶性配合物 反应生成了可溶性配合物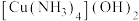 |
| D.金刚石可用作地质钻探钻头,是由于金刚石具有很高的硬度 |
您最近一年使用:0次
6 . 顺式甘氨酸铜结构如图。下列说法正确的是
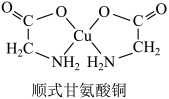
| A.O→Cu的配位键键能小于N→Cu的配位键键能 |
| B.顺式甘氨酸铜中Cu的配体数为4 |
| C.顺式甘氨酸铜是非极性分子 |
| D.顺式甘氨酸铜晶体的分子间作用力仅为范德华力 |
您最近一年使用:0次
名校
7 . “肼合成酶”以其中的 配合物为催化中心,可将
配合物为催化中心,可将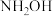 与
与 转化为肼
转化为肼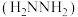 ,其反应历程如下所示。
,其反应历程如下所示。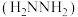 的燃烧热为
的燃烧热为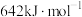 。
。
下列说法正确的是
 配合物为催化中心,可将
配合物为催化中心,可将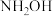 与
与 转化为肼
转化为肼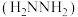 ,其反应历程如下所示。
,其反应历程如下所示。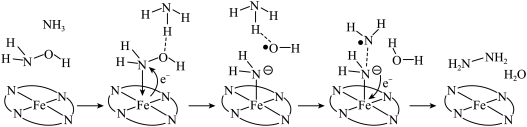
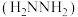 的燃烧热为
的燃烧热为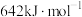 。
。下列说法正确的是
A.反应过程中 元素的化合价发生了变化 元素的化合价发生了变化 |
B.催化中心的 提供孤电子对,N提供空轨道 提供孤电子对,N提供空轨道 |
| C.反应涉及极性键与非极性键的断裂和生成 |
D.肼燃烧热的热化学方程式为: 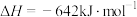 |
您最近一年使用:0次
2024-05-04更新
|
110次组卷
|
2卷引用:广西南宁三中2023-2024学年高二下学期3月阶段性学业测试化学试卷
名校
解题方法
8 . 三氯化铬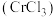 是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。 沸点为
沸点为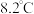 ,有毒,易水解。
,有毒,易水解。
(1)“热分解”发生反应的化学方程式为___________ 。
(2)“热反应”制无水 的实验装置如图所示(
的实验装置如图所示( 中加热装置略)。
中加热装置略)。 的目的是
的目的是___________ 。
②A中仪器X的名称是___________ ,其作用是___________ 。
③E中收集的物质含有___________ (写化学式)。
④尾气经___________ 处理后可循环使用。
(3)已知 配合物
配合物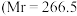 ,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取
溶于水,一定条件下结晶析出暗绿色晶体。称取 该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.
溶液,得到2. 白色沉淀。
白色沉淀。
① 中存在的化学键有
中存在的化学键有___________ (填序号)。
a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为___________ 。
 是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
 沸点为
沸点为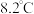 ,有毒,易水解。
,有毒,易水解。(1)“热分解”发生反应的化学方程式为
(2)“热反应”制无水
 的实验装置如图所示(
的实验装置如图所示( 中加热装置略)。
中加热装置略)。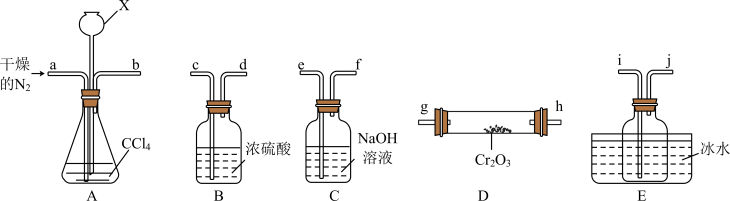
 的目的是
的目的是②A中仪器X的名称是
③E中收集的物质含有
④尾气经
(3)已知
 配合物
配合物 ,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取
溶于水,一定条件下结晶析出暗绿色晶体。称取 该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.
溶液,得到2. 白色沉淀。
白色沉淀。①
 中存在的化学键有
中存在的化学键有a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为
您最近一年使用:0次
名校
解题方法
9 . [Ni(NH3)6Cl2](二氯六氨合镍)是一种镍的配合物,实验室制备过程及部分装置如下:
②[Ni(NH3)6Cl2]在热水中分解。
请回答:
(1)步骤Ⅰ、Ⅱ中须要控制反应温度在0~10℃,可采取的措施是________ (任写一点即可)。
(2)写出步骤Ⅱ中发生反应的化学方程式________________ 。
(3)步骤Ⅲ,将蓝紫色晶体1置于图1装置中,先加入20 mL6 mol/L的HCl溶液至固体完全溶解,后慢慢加入60 mL浓氨水和氯化铵的混合溶液,静置至沉淀完全。________ ,装置b的作用是________ 。
②NH4Cl可降低浓氨水溶液的pH,利用平衡理论解释原因________ 。
③将步骤Ⅲ中的沉淀过滤,依次用________ ,________ 洗涤,室温真空干燥,即可获得纯净的蓝色晶体2。
(4)某小组以AgNO3溶液作标准液,K2CrO4溶液作为指示剂测定产品[Ni(NH3)6Cl2]中Cl-的质量分数,实验中滴定的结果发现[Ni(NH3)6Cl2]质量分数明显偏高。分析其原因,发现配制[Ni(NH3)6Cl2]待测液时少加了一种试剂。该试剂是______ (填“稀盐酸”或“稀硝酸”或“稀硫酸)
(5)丁二酮肟是检验Ni2+灵敏试剂可与Ni2+生成红色螯合物沉淀丁二酮肟镍(结构如图2)。
下列说法不正确的是______(填字母)。
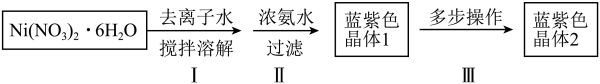
②[Ni(NH3)6Cl2]在热水中分解。
请回答:
(1)步骤Ⅰ、Ⅱ中须要控制反应温度在0~10℃,可采取的措施是
(2)写出步骤Ⅱ中发生反应的化学方程式
(3)步骤Ⅲ,将蓝紫色晶体1置于图1装置中,先加入20 mL6 mol/L的HCl溶液至固体完全溶解,后慢慢加入60 mL浓氨水和氯化铵的混合溶液,静置至沉淀完全。
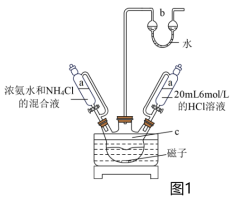
②NH4Cl可降低浓氨水溶液的pH,利用平衡理论解释原因
③将步骤Ⅲ中的沉淀过滤,依次用
(4)某小组以AgNO3溶液作标准液,K2CrO4溶液作为指示剂测定产品[Ni(NH3)6Cl2]中Cl-的质量分数,实验中滴定的结果发现[Ni(NH3)6Cl2]质量分数明显偏高。分析其原因,发现配制[Ni(NH3)6Cl2]待测液时少加了一种试剂。该试剂是
(5)丁二酮肟是检验Ni2+灵敏试剂可与Ni2+生成红色螯合物沉淀丁二酮肟镍(结构如图2)。
下列说法不正确的是______(填字母)。
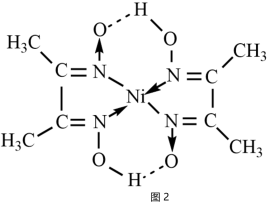
| A.图2中,元素的电负性O>N>C>H |
| B.图2分子中存在的化学键有共价键、配位键、氢键 |
| C.图2中N原子的杂化类型是sp3 |
| D.图2中Ni2+的配位数是4 |
您最近一年使用:0次
名校
解题方法
10 . 下列对有关事实的解释错误的是
| 选项 | 事实 | 解释 |
| A | 熔点: |  为离子晶体, 为离子晶体, 为分子晶体 为分子晶体 |
| B | 酸性: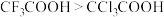 |  的相对分子质量小于 的相对分子质量小于 |
| C | 不同溶剂中 的溶解度: 的溶解度: |  、 、 为非极性分子,而 为非极性分子,而 为极性分子 为极性分子 |
| D | 结合氢离子的能力: | 甲基是推电子基团,使 分子中的N原子提供孤对电子的能力强于 分子中的N原子提供孤对电子的能力强于 分子中的N原子 分子中的N原子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



