名校
解题方法
1 . 已知短周期主族元素T、W、X、Y、Z的原子序数依次增大,分布在周期表前三周期,X的核外电子总数等于T、W的核外电子总数之和,下列说法不正确 的是

| A.该结构中存在配位键 |
| B.元素W、X、Y、Z均属于p区元素 |
| C.最高价氧化物对应水化物的酸性:W<X |
| D.简单氢化物的稳定性:Z>Y>X |
您最近一年使用:0次
名校
2 . 一种镍磷化合物催化氨硼烷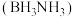 水解释氢的可能机理如图所示,其中中间体Ⅱ中与
水解释氢的可能机理如图所示,其中中间体Ⅱ中与 原子相连的氢原子被水中的羟基取代生成中间体Ⅲ。下列说法错误的是
原子相连的氢原子被水中的羟基取代生成中间体Ⅲ。下列说法错误的是
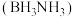 水解释氢的可能机理如图所示,其中中间体Ⅱ中与
水解释氢的可能机理如图所示,其中中间体Ⅱ中与 原子相连的氢原子被水中的羟基取代生成中间体Ⅲ。下列说法错误的是
原子相连的氢原子被水中的羟基取代生成中间体Ⅲ。下列说法错误的是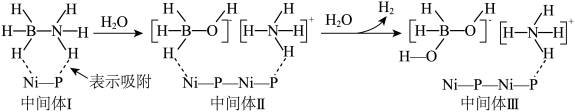
A.氨硼烷中 和 和 原子都是 原子都是 杂化 杂化 |
B.用 代替 代替 作反应物,有 作反应物,有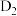 生成 生成 |
C.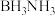 分子中含有配位键 分子中含有配位键 |
D.由Ⅱ→Ⅲ推断,水解的最终产物为 和 和 |
您最近一年使用:0次
名校
3 . M、W、X、Y为原子序数依次增大的短周期主族元素,其中W、X、Y在第二周期且相邻,W与Y的质子数之和是X的2倍,Z元素的基态原子3d轨道上有2个未成对电子,且价层电子的空间运动状态有6种,由5种元素形成的一种配位化合物结构如图所示,下列说法正确的是
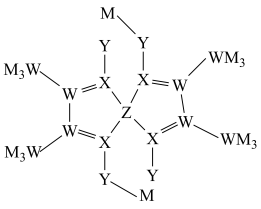
A. 基态原子核外电子有5种不同的空间运动状态 基态原子核外电子有5种不同的空间运动状态 |
B.简单氢化物的还原性和沸点均为: |
C.同周期中第一电离能和电负性小于 的元素均是4种 的元素均是4种 |
D. 该物质中含配位键的数目为 该物质中含配位键的数目为 ,且该物质中元素 ,且该物质中元素 的化合价为0价 的化合价为0价 |
您最近一年使用:0次
名校
解题方法
4 . 一种比率光声探针M与 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:_______ ,基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为_______ 。
(2)均为平面结构的吡咯( )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为_______ ,原因是_______ 。
(3) 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中
中 键角
键角_______  中
中 键角(填“大于”“小于”或“等于”)。
键角(填“大于”“小于”或“等于”)。
(4) (
( )中
)中 比
比 中的更
中的更_______ (填“难”或“易”)断裂。其原因是_______ 。
元素周期表中,第四周期元素单质及其化合物在化工生产和研究中有重要的应用。
(5)在浓 的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为
的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为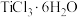 的晶体,该晶体中两种配体的物质的量之比为
的晶体,该晶体中两种配体的物质的量之比为 ,则由该配合离子组成的晶体化学式还可以写为
,则由该配合离子组成的晶体化学式还可以写为_______ 。
(6)硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的 层与带负电的
层与带负电的 层交替堆叠。据此推断硒氧化铋的化学式为
层交替堆叠。据此推断硒氧化铋的化学式为_______ 。晶胞棱边夹角均为 ,则晶体密度的计算式为
,则晶体密度的计算式为_______  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为(3)
 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中
中 键角
键角 中
中 键角(填“大于”“小于”或“等于”)。
键角(填“大于”“小于”或“等于”)。(4)
 (
( )中
)中 比
比 中的更
中的更元素周期表中,第四周期元素单质及其化合物在化工生产和研究中有重要的应用。
(5)在浓
 的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为
的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为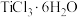 的晶体,该晶体中两种配体的物质的量之比为
的晶体,该晶体中两种配体的物质的量之比为 ,则由该配合离子组成的晶体化学式还可以写为
,则由该配合离子组成的晶体化学式还可以写为(6)硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的
 层与带负电的
层与带负电的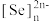 层交替堆叠。据此推断硒氧化铋的化学式为
层交替堆叠。据此推断硒氧化铋的化学式为 ,则晶体密度的计算式为
,则晶体密度的计算式为 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
5 . 软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)可以制取电子工业原料MnCO3固体。
(1)浸取。将软锰矿粉和黄铁矿粉投入20%H2SO4溶液中浸取锰元素,反应机理如图-1所示。___________ (填序号)。
A.适当提高浸取温度 B.加快搅拌 C.延长浸取时间 D.加入HNO3
②Fe2+与Fe3+之间的循环是浸取的关键,浸取后期该循环过程受阻,其原因是___________ 。
③一定条件下,用足量黄铁矿浸锰,浸取时间与溶液中Fe2+、Fe3+浓度关系如图-2所示。80~100min时,Fe3+浓度变化较小而Fe2+浓度迅速上升的原因是___________ 。___________ (用离子方程式表示)。
(3)制备MnCO3。向滤液中滴加NH4HCO3溶液至沉淀完全,过滤、洗涤、干燥,得MnCO3固体。
①检验沉淀是否洗涤干净的方法是___________ 。
②不使用Na2CO3溶液做沉淀剂的原因是___________ 。
(4)滤渣利用。浸锰后的滤渣可生产补铁剂甘氨酸亚铁 [Fe(H2NCH2COO)2·2H2O],该物质中Fe2+与H2NCH2COO—配位形成两个五元环。请在下图中补充完整该物质的结构简式________ 。
(1)浸取。将软锰矿粉和黄铁矿粉投入20%H2SO4溶液中浸取锰元素,反应机理如图-1所示。

A.适当提高浸取温度 B.加快搅拌 C.延长浸取时间 D.加入HNO3
②Fe2+与Fe3+之间的循环是浸取的关键,浸取后期该循环过程受阻,其原因是
③一定条件下,用足量黄铁矿浸锰,浸取时间与溶液中Fe2+、Fe3+浓度关系如图-2所示。80~100min时,Fe3+浓度变化较小而Fe2+浓度迅速上升的原因是

(3)制备MnCO3。向滤液中滴加NH4HCO3溶液至沉淀完全,过滤、洗涤、干燥,得MnCO3固体。
①检验沉淀是否洗涤干净的方法是
②不使用Na2CO3溶液做沉淀剂的原因是
(4)滤渣利用。浸锰后的滤渣可生产补铁剂甘氨酸亚铁 [Fe(H2NCH2COO)2·2H2O],该物质中Fe2+与H2NCH2COO—配位形成两个五元环。请在下图中补充完整该物质的结构简式

您最近一年使用:0次
6 . 下列说法不正确 的是
A.基态Cr原子的价层电子轨道式: |
B.共价化合物Al2Cl6中所有原子均满足8电子稳定结构,其结构式: |
C.N,N-二甲基甲酰胺: |
D.N2、N 、N4、N 、N4、N 互为同素异形体 互为同素异形体 |
您最近一年使用:0次
7 . 在处理NO废气的过程中,催化剂 会逐渐失活变为
会逐渐失活变为 。
。
某小组为解决这一问题,实验研究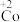 和
和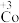 之间的相互转化。
之间的相互转化。
资料:i.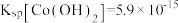 ;
;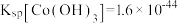 。
。
ii.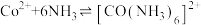
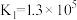 ;
;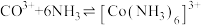
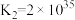 。
。
iii. 和
和 在酸性条件下均能生成
在酸性条件下均能生成 。
。
(1)探 的还原性
的还原性
实验I 粉红色的 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。
实验Ⅱ 向 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。 可以被酸性
可以被酸性 溶液氧化。乙同学补充实验IV,
溶液氧化。乙同学补充实验IV,_______ (补全实验操作及现象),否定了该观点。
②探究碱性条件下 的还原性,进行实验。
的还原性,进行实验。_______ 。
③根据氧化还原反应规律解释还原性 :
: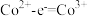 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使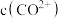 和
和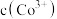 均降低,但
均降低,但_______ 降低的程度更大,还原剂的还原性增强。
(2)探究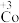 的氧化性
的氧化性
①根据实验Ⅲ和IV推测氧化性: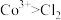 ,设计实验证明:向V中得到的棕褐色沉淀中,
,设计实验证明:向V中得到的棕褐色沉淀中,_______ (补全实验操作及现象),反应方程式为_______ 。
②向V中得到的棕褐色沉淀中,滴加 溶液,加入催化剂,产生无色气泡,该气体是
溶液,加入催化剂,产生无色气泡,该气体是_______ 。
(3)催化剂 的失活与再生
的失活与再生
①结合数据解释 能被氧化为
能被氧化为 而失活的原因:
而失活的原因:_______ 。
②根据以上实验,设计物质转化流程图 实现 的再生:
的再生:_______ 。示例:
 会逐渐失活变为
会逐渐失活变为 。
。某小组为解决这一问题,实验研究
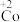 和
和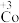 之间的相互转化。
之间的相互转化。资料:i.
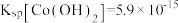 ;
;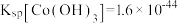 。
。ii.
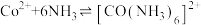
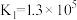 ;
;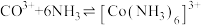
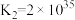 。
。iii.
 和
和 在酸性条件下均能生成
在酸性条件下均能生成 。
。(1)探
 的还原性
的还原性实验I 粉红色的
 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。实验Ⅱ 向
 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。
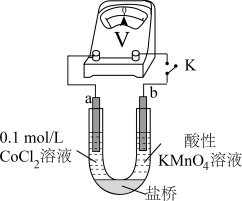
 可以被酸性
可以被酸性 溶液氧化。乙同学补充实验IV,
溶液氧化。乙同学补充实验IV,②探究碱性条件下
 的还原性,进行实验。
的还原性,进行实验。实验V: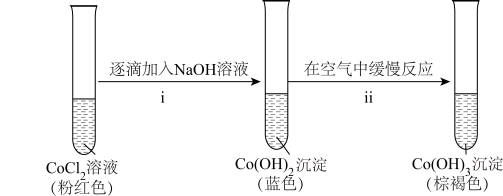
③根据氧化还原反应规律解释还原性
 :
: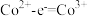 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使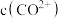 和
和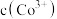 均降低,但
均降低,但(2)探究
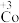 的氧化性
的氧化性①根据实验Ⅲ和IV推测氧化性:
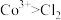 ,设计实验证明:向V中得到的棕褐色沉淀中,
,设计实验证明:向V中得到的棕褐色沉淀中,②向V中得到的棕褐色沉淀中,滴加
 溶液,加入催化剂,产生无色气泡,该气体是
溶液,加入催化剂,产生无色气泡,该气体是(3)催化剂
 的失活与再生
的失活与再生①结合数据解释
 能被氧化为
能被氧化为 而失活的原因:
而失活的原因:②根据以上实验,设计物质转化
 的再生:
的再生:
您最近一年使用:0次
名校
解题方法
8 .  是一种典型的配合物,下列有关说法中正确的是
是一种典型的配合物,下列有关说法中正确的是
 是一种典型的配合物,下列有关说法中正确的是
是一种典型的配合物,下列有关说法中正确的是A.基态N原子的轨道表示式为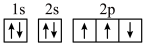 |
| B.第一电离能大小顺序:N>S>O |
C.1mol  中含有12mol共价键 中含有12mol共价键 |
D.N原子和S原子的杂化方式都为 杂化 杂化 |
您最近一年使用:0次
名校
9 . 近日,济南大学原长洲教授制备了一种高性能的钾离子电池负极材料(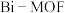 ),反应可简单表示为
),反应可简单表示为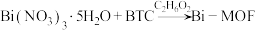 。回答下列问题:
。回答下列问题:
(1)铋(Bi)位于元素周期表中第6周期ⅤA族,基态Bi原子的价层电子排布式为___________ 。 中阴离子的立体构型为
中阴离子的立体构型为___________ 。基态O原子核外成对电子数与未成对电子数之比为___________ 。
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为___________ 。 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。 原子的杂化类型为
原子的杂化类型为___________ 。
②下列叙述正确的是___________ (填字母)。
A.含该超分子的物质属于分子晶体 B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变 D.冠醚与碱金属离子之间形成氢键
(4)该电池负极材料( )充电时,会形成钾铋合金
)充电时,会形成钾铋合金 ,其晶胞结构如图,已知该晶胞底边长为
,其晶胞结构如图,已知该晶胞底边长为 ,高为
,高为 ,
, 为阿伏伽德罗常数的值。该晶体密度
为阿伏伽德罗常数的值。该晶体密度___________  (只列计算式)。
(只列计算式)。
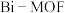 ),反应可简单表示为
),反应可简单表示为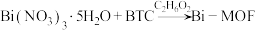 。回答下列问题:
。回答下列问题:(1)铋(Bi)位于元素周期表中第6周期ⅤA族,基态Bi原子的价层电子排布式为
 中阴离子的立体构型为
中阴离子的立体构型为(2)BTC分子中组成元素C、N、O的电负性由大到小排序为
 的沸点高于
的沸点高于 ,原因是
,原因是(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
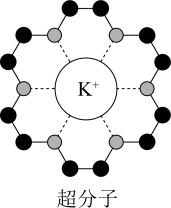
 原子的杂化类型为
原子的杂化类型为②下列叙述正确的是
A.含该超分子的物质属于分子晶体 B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变 D.冠醚与碱金属离子之间形成氢键
(4)该电池负极材料(
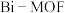 )充电时,会形成钾铋合金
)充电时,会形成钾铋合金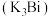 ,其晶胞结构如图,已知该晶胞底边长为
,其晶胞结构如图,已知该晶胞底边长为 ,高为
,高为 ,
, 为阿伏伽德罗常数的值。该晶体密度
为阿伏伽德罗常数的值。该晶体密度 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
名校
解题方法
10 . 甲醇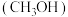 是一种用途广泛的基础有机原料和优质燃料。
是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜做催化剂的条件下直接氧化成甲醛 。
。
①基态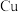 原子的价层电子的轨道表示式为
原子的价层电子的轨道表示式为_______ 。
②甲醛中碳原子的杂化方式为_______ 杂化,其组成元素的电负性由小到大 的顺序为_______ 。
(2)在一定条件下,甲醇可转化为乙酸甲酯 ,一个乙酸甲酯分子中
,一个乙酸甲酯分子中 键和
键和 键个数之比为
键个数之比为_______ 。
(3)由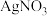 制备的
制备的 可用于检验醛基。
可用于检验醛基。 中配位原子为
中配位原子为_______ , 的空间构型为
的空间构型为_______ 。
(4)图中银晶胞的边长为 ,该晶胞中
,该晶胞中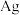 的配位数为
的配位数为_______ ;该晶胞密度为_______ 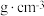 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
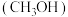 是一种用途广泛的基础有机原料和优质燃料。
是一种用途广泛的基础有机原料和优质燃料。(1)甲醇可以在铜做催化剂的条件下直接氧化成甲醛
 。
。①基态
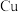 原子的价层电子的轨道表示式为
原子的价层电子的轨道表示式为②甲醛中碳原子的杂化方式为
(2)在一定条件下,甲醇可转化为乙酸甲酯
 ,一个乙酸甲酯分子中
,一个乙酸甲酯分子中 键和
键和 键个数之比为
键个数之比为(3)由
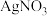 制备的
制备的 可用于检验醛基。
可用于检验醛基。 中配位原子为
中配位原子为 的空间构型为
的空间构型为(4)图中银晶胞的边长为
 ,该晶胞中
,该晶胞中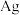 的配位数为
的配位数为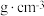 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。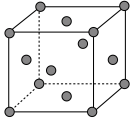
您最近一年使用:0次
7日内更新
|
293次组卷
|
5卷引用:天津市河北区2023-2024学年高三下学期二模化学试卷



