1 . 以废旧镍氢电池的金属电极芯[主要成分为 和
和 ,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
②酸性条件下的氧化性: >
> 。
。
回答下列问题:
(1)“氧化”时 作
作_____ (填“氧化剂”或“还原剂”,下同),“浸出”时 作
作______ 。
(2)写出“沉钴1”中 转化为
转化为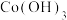 的离子方程式:
的离子方程式:_______ 。
(3)设计“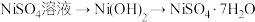 ”的目的是
”的目的是_______ 。
(4)“沉钴2”中发生反应的离子方程式为_______ ,_______ (填“能”或“不能”)用 替代
替代 ,理由是
,理由是_______ 。
(5)设计实验检验 是否洗净:
是否洗净:_______ 。
(6)水溶液中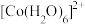 、
、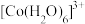 的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能:
的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能: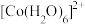
_______ (填“>”“<”或“=”)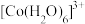 。
。
(7)镍单质晶胞有两种形式,如图所示。已知:图1晶胞棱长为acm,图2中晶胞底边长为bcm,高为ccm。图1、图2(正六棱柱)镍晶体密度之比为_______ 。
 和
和 ,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
| 离子 |  |  |  |  |  |  |
| 开始沉淀的pH | 6.3 | 1.5 | 3.4 | 6.2 | 7.2 | |
| 完全沉淀的pH | 8.3 | 2.8 | 4.7 | 8.9 | 9.2 | 1.1 |
 >
> 。
。回答下列问题:
(1)“氧化”时
 作
作 作
作(2)写出“沉钴1”中
 转化为
转化为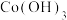 的离子方程式:
的离子方程式:(3)设计“
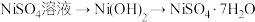 ”的目的是
”的目的是(4)“沉钴2”中发生反应的离子方程式为
 替代
替代 ,理由是
,理由是(5)设计实验检验
 是否洗净:
是否洗净:(6)水溶液中
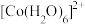 、
、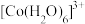 的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能:
的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能: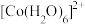
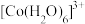 。
。(7)镍单质晶胞有两种形式,如图所示。已知:图1晶胞棱长为acm,图2中晶胞底边长为bcm,高为ccm。图1、图2(正六棱柱)镍晶体密度之比为

您最近一年使用:0次
昨日更新
|
36次组卷
|
3卷引用:2024届河南省百所名校仿真模拟大联考三模考试理综试题-高中化学
2 . 25℃,金属阳离子 与
与 逐步结合的平衡常数如下:
逐步结合的平衡常数如下:
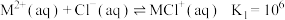


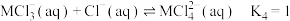
下列说法正确的是[已知:平均配位数
 与
与 逐步结合的平衡常数如下:
逐步结合的平衡常数如下: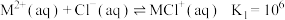


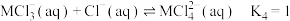
下列说法正确的是[已知:平均配位数

A.溶液中 数目越多, 数目越多,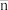 越大 越大 |
B.当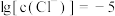 时, 时, 与 与 间不能形成配位键 间不能形成配位键 |
C.已知 ,可推知 ,可推知 的金属活动性强于 的金属活动性强于 |
D.当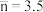 时,溶液中 时,溶液中 略大于 略大于 |
您最近一年使用:0次
名校
3 . 现有两种化学式相同但颜色不同的配合物,它们的化学式均为: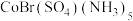 ,配合物A为红色加入
,配合物A为红色加入 生黄色沉淀,但加入
生黄色沉淀,但加入 不产生沉淀,紫色配合物B加入
不产生沉淀,紫色配合物B加入 不产生沉淀,但加入
不产生沉淀,但加入 产生白色沉淀。关于两种配合物说法错误的是:
产生白色沉淀。关于两种配合物说法错误的是:
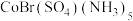 ,配合物A为红色加入
,配合物A为红色加入 生黄色沉淀,但加入
生黄色沉淀,但加入 不产生沉淀,紫色配合物B加入
不产生沉淀,紫色配合物B加入 不产生沉淀,但加入
不产生沉淀,但加入 产生白色沉淀。关于两种配合物说法错误的是:
产生白色沉淀。关于两种配合物说法错误的是:A.红色配合物化学式为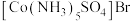 紫色配合物化学式为 紫色配合物化学式为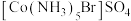 |
| B.两种配合物的中心原子配位数都是6 |
| C.两种配合物中心离子价态均为+3 |
D.两种配合物中心离子均为 杂化 杂化 |
您最近一年使用:0次
4 .  是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价
是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价 。
。 呈黄色,
呈黄色, 呈绿色,
呈绿色, 呈蓝色等;预测
呈蓝色等;预测 呈
呈_______ 色,原因是_______ 。
(2) 可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。
可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。_______ (填“ ”或“
”或“ ”)。
”)。
(3)充电时,每个 晶胞完全转化为
晶胞完全转化为 晶胞。每个
晶胞。每个 晶胞中
晶胞中 个数为
个数为_______ (用含 的代数式作答)。当
的代数式作答)。当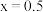 时,
时,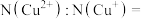
_______ 。 晶胞中互不相邻的
晶胞中互不相邻的 围成的空间结构是
围成的空间结构是_______ 。
(4) 可以与稀硫酸反应生成
可以与稀硫酸反应生成 ,比较
,比较 和
和 键角的大小:
键角的大小: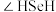
_______ (填“>”或“<”)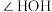 ,说明原因:
,说明原因:_______ 。
(5)立方 晶胞的晶胞参数为
晶胞的晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为_______  (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价
是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价 。
。
 呈黄色,
呈黄色, 呈绿色,
呈绿色, 呈蓝色等;预测
呈蓝色等;预测 呈
呈(2)
 可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。
可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。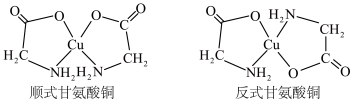
 ”或“
”或“ ”)。
”)。(3)充电时,每个
 晶胞完全转化为
晶胞完全转化为 晶胞。每个
晶胞。每个 晶胞中
晶胞中 个数为
个数为 的代数式作答)。当
的代数式作答)。当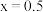 时,
时,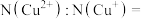
 晶胞中互不相邻的
晶胞中互不相邻的 围成的空间结构是
围成的空间结构是(4)
 可以与稀硫酸反应生成
可以与稀硫酸反应生成 ,比较
,比较 和
和 键角的大小:
键角的大小: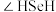
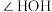 ,说明原因:
,说明原因:(5)立方
 晶胞的晶胞参数为
晶胞的晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为 (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
5 . 铁 、钴
、钴 、镍
、镍 是第四周期第Ⅷ族的元素,称为铁系元素,相关化合物在科研及生产生活中应用广泛。
是第四周期第Ⅷ族的元素,称为铁系元素,相关化合物在科研及生产生活中应用广泛。
I.邻二氮菲 与
与 生成稳定的橙红色邻二氮菲亚铁离子
生成稳定的橙红色邻二氮菲亚铁离子 ,可用于
,可用于 的测定,邻二氮菲的结构简式如图所示。
的测定,邻二氮菲的结构简式如图所示。 中,存在的化学键有
中,存在的化学键有___________ 。
a.配位键 b.离子键 c. 键 d.氢键
键 d.氢键
②用邻二氮菲测定 浓度时应控制
浓度时应控制 为
为 的适宜范围,请解释原因:
的适宜范围,请解释原因:___________ 。
③补铁剂中 易变质,请从结构角度解释其原因
易变质,请从结构角度解释其原因___________ 。
④ 检验补铁剂是否变质,
检验补铁剂是否变质, 中所有原子均满足最外层8电子结构,写出
中所有原子均满足最外层8电子结构,写出 的电子式
的电子式___________ 。
II. 能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如图:
能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如图: 元素在周期表中属于
元素在周期表中属于___________ 区(填“ ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。
② 元素的第一电离能由大到小的顺序为
元素的第一电离能由大到小的顺序为___________ 。 和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:
和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示: 原子最近的
原子最近的 原子有
原子有___________ 个。
②已知该晶体的边长为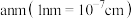 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为___________  。
。
 、钴
、钴 、镍
、镍 是第四周期第Ⅷ族的元素,称为铁系元素,相关化合物在科研及生产生活中应用广泛。
是第四周期第Ⅷ族的元素,称为铁系元素,相关化合物在科研及生产生活中应用广泛。I.邻二氮菲
 与
与 生成稳定的橙红色邻二氮菲亚铁离子
生成稳定的橙红色邻二氮菲亚铁离子 ,可用于
,可用于 的测定,邻二氮菲的结构简式如图所示。
的测定,邻二氮菲的结构简式如图所示。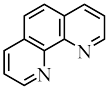
 中,存在的化学键有
中,存在的化学键有a.配位键 b.离子键 c.
 键 d.氢键
键 d.氢键②用邻二氮菲测定
 浓度时应控制
浓度时应控制 为
为 的适宜范围,请解释原因:
的适宜范围,请解释原因:③补铁剂中
 易变质,请从结构角度解释其原因
易变质,请从结构角度解释其原因④
 检验补铁剂是否变质,
检验补铁剂是否变质, 中所有原子均满足最外层8电子结构,写出
中所有原子均满足最外层8电子结构,写出 的电子式
的电子式II.
 能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如图:
能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如图:
 元素在周期表中属于
元素在周期表中属于 ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。②
 元素的第一电离能由大到小的顺序为
元素的第一电离能由大到小的顺序为③对羟基苯甲醛(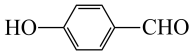 )的沸点为
)的沸点为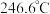 ,而水杨醛(
,而水杨醛(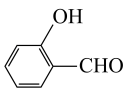 )的沸点为
)的沸点为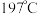 ,请从结构角度解释二者沸点差异的原因
,请从结构角度解释二者沸点差异的原因
 和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:
和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:
 原子最近的
原子最近的 原子有
原子有②已知该晶体的边长为
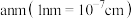 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为 。
。
您最近一年使用:0次
解题方法
6 . H、C、N、F、Cl、Ba等是几种重要的元素,Ba的一种氢化物是一种重要的储氢晶体。回答下列问题:
(1)处于基态的F和N原子,下列参数前者小于后者的是________ (填字母)。
A.最外层电子数 B.未成对电子数 C.第一电离能 D.原子半径 E.电负性
(2)咪唑(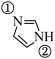 )具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如
)具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如 )形成配位键的原因:
)形成配位键的原因:________ 。
(3) 、
、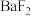 两种物质中熔点较高的是
两种物质中熔点较高的是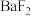 ,其原因是
,其原因是________ 。
(4)三氯乙腈 和过量
和过量 反应可得到一种高能物质M,其结构如图,则
反应可得到一种高能物质M,其结构如图,则 分子中
分子中 键与
键与 键的数目比为
键的数目比为________ , 的空间构型为
的空间构型为________ ,M中N原子杂化方式为________ 。 与
与 形成的氢化物储氢(用H表示)后的晶胞如图:
形成的氢化物储氢(用H表示)后的晶胞如图:________ (填“H”或“ ”)。
”)。
②原子分数坐标为 ,
, ,
, ,d原子的坐标为
,d原子的坐标为________ 。
③根据上图所示,储氢后该晶体的密度为________  。
。
(1)处于基态的F和N原子,下列参数前者小于后者的是
A.最外层电子数 B.未成对电子数 C.第一电离能 D.原子半径 E.电负性
(2)咪唑(
 )具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如
)具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如 )形成配位键的原因:
)形成配位键的原因:(3)
 、
、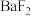 两种物质中熔点较高的是
两种物质中熔点较高的是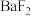 ,其原因是
,其原因是(4)三氯乙腈
 和过量
和过量 反应可得到一种高能物质M,其结构如图,则
反应可得到一种高能物质M,其结构如图,则 分子中
分子中 键与
键与 键的数目比为
键的数目比为 的空间构型为
的空间构型为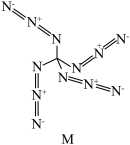
 与
与 形成的氢化物储氢(用H表示)后的晶胞如图:
形成的氢化物储氢(用H表示)后的晶胞如图:
 ”)。
”)。②原子分数坐标为
 ,
, ,
, ,d原子的坐标为
,d原子的坐标为③根据上图所示,储氢后该晶体的密度为
 。
。
您最近一年使用:0次
7 . 实验室在如图所示装置中制取 ,将
,将 通入
通入 溶液,当生成的蓝色沉淀溶解为深蓝色溶液,再滴加乙醇可获得
溶液,当生成的蓝色沉淀溶解为深蓝色溶液,再滴加乙醇可获得 晶体。已知:
晶体。已知: 呈蓝色。下列说法
呈蓝色。下列说法不正确 的是
 ,将
,将 通入
通入 溶液,当生成的蓝色沉淀溶解为深蓝色溶液,再滴加乙醇可获得
溶液,当生成的蓝色沉淀溶解为深蓝色溶液,再滴加乙醇可获得 晶体。已知:
晶体。已知: 呈蓝色。下列说法
呈蓝色。下列说法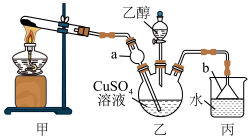
A.在装置甲试管中加入 和 和 固体加热制取 固体加热制取 |
B.装置乙中的 和装置丙中的 和装置丙中的 均可防止倒吸 均可防止倒吸 |
C. 晶体在乙醇中的溶解度小于在水中的溶解度 晶体在乙醇中的溶解度小于在水中的溶解度 |
D.与 相比, 相比, 更易与 更易与 形成配位键 形成配位键 |
您最近一年使用:0次
名校
解题方法
8 . 过渡金属钛(Ti)性能优越,是继铁、铝之后应用广泛的“第三金属”。
(1)钛元素位于周期表的___________ 区;基态 原子核外电子占据的轨道数为
原子核外电子占据的轨道数为___________ 个。
(2)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示。___________ (填字母)。
a.含有手性碳原子
b.2号氧提供孤电子对与钛离子形成配位键
c. 号原子不在同一平面上
号原子不在同一平面上
d.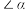 大于
大于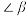
(3)嫦娥三号卫星上的PIC元件(热敏电阻)的主要成分——钡钛矿的晶胞结构如图所示。 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的边长为
,则该晶胞的边长为___________  (用含
(用含 、
、 的式子表示)。
的式子表示)。
(1)钛元素位于周期表的
 原子核外电子占据的轨道数为
原子核外电子占据的轨道数为(2)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示。

a.含有手性碳原子
b.2号氧提供孤电子对与钛离子形成配位键
c.
 号原子不在同一平面上
号原子不在同一平面上 d.
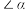 大于
大于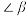
(3)嫦娥三号卫星上的PIC元件(热敏电阻)的主要成分——钡钛矿的晶胞结构如图所示。

 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的边长为
,则该晶胞的边长为 (用含
(用含 、
、 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
9 . 用以下装置制备钴(Ⅲ)的配合物并测定该配合物的组成。
Ⅰ.制备钴(Ⅲ)的配合物
实验装置如图所示(省略夹持装置),操作过程如下:
步骤2:用恒压滴液漏斗将双氧水缓慢滴入装置B的三颈烧瓶中,滴加结束后再缓慢滴加4mol/L盐酸(在通风橱内进行),在85℃水浴中加热20min。
步骤3:冷却至室温,抽滤,精制,得纯净产品。
(1)仪器a的名称为_______ 。
(2)判断装置A中反应完全的标志为_______ 。
(3)实现装置A和B中溶液混合的操作是_______ 。
(4)双氧水的作用为_______ 。
(5)水浴温度控制在85℃的原因是_______ 。
(6)某同学用图装置进行抽滤,该装置存在的问题有_______ 。
25℃时,用电导仪测出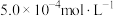 该配合物稀溶液的电导率
该配合物稀溶液的电导率 为
为 。已知:
。已知:
①25℃时,稀溶液中,配合物电离出的离子总数与摩尔电导 的关系如下:
的关系如下:
摩尔电导 为配合物的物质的量浓度
为配合物的物质的量浓度 为配合物的电导率
为配合物的电导率 。
。
②该配合物在水中的电离方程式为 。
。
③该配合物中心离子的配位数为6。
(7)通过计算,
_____ 。写出装置B中制备钴(Ⅲ)的配合物的总的化学方程式_______ 。
Ⅰ.制备钴(Ⅲ)的配合物
实验装置如图所示(省略夹持装置),操作过程如下:

步骤2:用恒压滴液漏斗将双氧水缓慢滴入装置B的三颈烧瓶中,滴加结束后再缓慢滴加4mol/L盐酸(在通风橱内进行),在85℃水浴中加热20min。
步骤3:冷却至室温,抽滤,精制,得纯净产品。
(1)仪器a的名称为
(2)判断装置A中反应完全的标志为
(3)实现装置A和B中溶液混合的操作是
(4)双氧水的作用为
(5)水浴温度控制在85℃的原因是
(6)某同学用图装置进行抽滤,该装置存在的问题有

25℃时,用电导仪测出
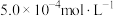 该配合物稀溶液的电导率
该配合物稀溶液的电导率 为
为 。已知:
。已知:①25℃时,稀溶液中,配合物电离出的离子总数与摩尔电导
 的关系如下:
的关系如下:| 离子总数 | 2 | 3 | 4 | 5 |
 |  |  |  |  |
 为配合物的物质的量浓度
为配合物的物质的量浓度 为配合物的电导率
为配合物的电导率 。
。②该配合物在水中的电离方程式为
 。
。③该配合物中心离子的配位数为6。
(7)通过计算,

您最近一年使用:0次
10 . 过渡金属氧化物因具有特殊的电学、磁学性质引起研究者的广泛关注。回答下列问题:
(1)①第一电离能 、
、 、
、 由小到大的顺序是
由小到大的顺序是_______ 。Tc是与Mn同一副族的相邻周期元素,与Mn有相似的价电子排布,基态Tc原子的价电子排布式为_______ 。
②下列O原子电子排布式表示的状态中,能量最低和最高的分别为_______ 、_______ (填标号)
A. B.
B.
C. D.
D.
(2) 可形成稳定的八面体配合物,结构如图所示。含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。该配合物中Tc原子参与杂化的原子轨道类型有
可形成稳定的八面体配合物,结构如图所示。含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。该配合物中Tc原子参与杂化的原子轨道类型有_______ 种, 该配合物中通过螯合作用形成的配位键有
该配合物中通过螯合作用形成的配位键有_______ mol。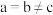 ,
, )结构如图所示,r大于
)结构如图所示,r大于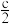 。X晶胞中Tc的配位数是
。X晶胞中Tc的配位数是_______ ;A点Sr原子的分数坐标是_______ 。若阿伏加德罗常数的值为 ,化合物X的密度
,化合物X的密度
_______  (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
(1)①第一电离能
 、
、 、
、 由小到大的顺序是
由小到大的顺序是②下列O原子电子排布式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(2)
 可形成稳定的八面体配合物,结构如图所示。含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。该配合物中Tc原子参与杂化的原子轨道类型有
可形成稳定的八面体配合物,结构如图所示。含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。该配合物中Tc原子参与杂化的原子轨道类型有 该配合物中通过螯合作用形成的配位键有
该配合物中通过螯合作用形成的配位键有
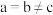 ,
, )结构如图所示,r大于
)结构如图所示,r大于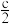 。X晶胞中Tc的配位数是
。X晶胞中Tc的配位数是 ,化合物X的密度
,化合物X的密度
 (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



