解题方法
1 . 我国科学家研发的水系可逆Zn-CO2电池可吸收利用CO2.将两组正离子、负离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的H2O解离成H+和OH—,工作原理如图所示:_____ 。
(2)充电时复合膜中向多孔Pd纳米片极移动的离子是_____ ,放电时正极的电极反应式为_____ 。
(3)下列说法中正确的是_____。
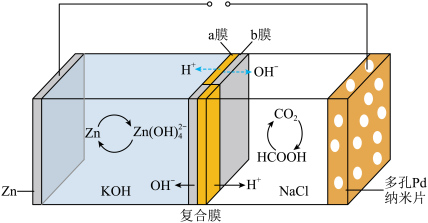
(2)充电时复合膜中向多孔Pd纳米片极移动的离子是
(3)下列说法中正确的是_____。
| A.放电时锌做阳极 |
| B.充电时多孔Pd纳米片极发生还原反应 |
| C.Na2[Zn(OH)4]中只存在离子键和配位键 |
D.Zn(OH) 可在足量稀硫酸中转化为Zn2+ 可在足量稀硫酸中转化为Zn2+ |
您最近一年使用:0次
解题方法
2 . 硅材料在生活中占有重要地位。
(1)太阳能电池板主要材料为单晶硅或多晶硅。硅原子核外未成对电子数为___________ 。单晶硅的晶体类型为___________ 。
A.离子晶体 B.分子晶体 C.共价晶体 D.金属晶体
(2)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、②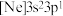 、③
、③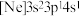 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(3)硅和卤素单质反应可以得到 ,
, 的熔沸点如下表:
的熔沸点如下表:
①气态 分子的空间构型是
分子的空间构型是___________ 。
A.正四面体形 B.三角锥形 C.角形 D.直线形
②0℃时, 、
、 、
、 、
、 呈液态的是
呈液态的是___________ 。
A. B.
B. C.
C. D.
D.
③比较上述 的熔沸点,分析其变化规律及原因
的熔沸点,分析其变化规律及原因___________ 。
(4) 与N-甲基咪唑
与N-甲基咪唑 反应可以得到
反应可以得到 ,其结构如下图所示:
,其结构如下图所示:___________ 。
(5)硅合金具有良好的性能。
①下列关于合金的说法错误的是___________ 。
A.熔点高于组成金属 B.可能含有非金属
C.硬度通常比组成金属大 D.一般比单一金属用途更广
②白铜是我国使用最早的合金之一,白铜晶胞结构如图所示(Cu位于面心),该晶胞含有的Cu原子和Ni原子个数分别为___________ 、___________ 。已知晶体密度为dg·cm-3,设NA为阿伏加德罗常数的值。Ni和Ni之间的最短距离为___________ nm。
(1)太阳能电池板主要材料为单晶硅或多晶硅。硅原子核外未成对电子数为
A.离子晶体 B.分子晶体 C.共价晶体 D.金属晶体
(2)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、②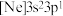 、③
、③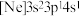 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.得电子能力:①>② |
| B.微粒半径:③>①>② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.电子排布属于基态原子(或离子)的是:①② |
 ,
, 的熔沸点如下表:
的熔沸点如下表: |  |  |  | |
| 熔点/℃ | -90.0 | -69.8 | 5.6 | 120.7 |
| 沸点/℃ | -85.8 | 57.8 | 154.2 | 287.7 |
 分子的空间构型是
分子的空间构型是A.正四面体形 B.三角锥形 C.角形 D.直线形
②0℃时,
 、
、 、
、 、
、 呈液态的是
呈液态的是A.
 B.
B. C.
C. D.
D.
③比较上述
 的熔沸点,分析其变化规律及原因
的熔沸点,分析其变化规律及原因(4)
 与N-甲基咪唑
与N-甲基咪唑 反应可以得到
反应可以得到 ,其结构如下图所示:
,其结构如下图所示:
(5)硅合金具有良好的性能。
①下列关于合金的说法错误的是
A.熔点高于组成金属 B.可能含有非金属
C.硬度通常比组成金属大 D.一般比单一金属用途更广
②白铜是我国使用最早的合金之一,白铜晶胞结构如图所示(Cu位于面心),该晶胞含有的Cu原子和Ni原子个数分别为

您最近一年使用:0次
解题方法
3 . 联氨(N2H4)又称肼,在航天、能源等领域具有广泛应用。
Ⅰ.N2H4分子中所有原子均达到稀有气体原子的稳定结构。
(1)写出N2H4的电子式。___________
(2)N2H4晶体受热熔化时,破坏的作用力有___________。
(3)酸碱质子理论提出:凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱。
①由N2H4+H2O N2H
N2H +OH- 可知N2H4是
+OH- 可知N2H4是___________ 。
A.酸 B.碱
②选择足量的盐酸或NaOH溶液与N2H4充分反应,生成盐的化学式为___________ 。
Ⅱ.肼具有强还原性,可作火箭推进剂燃料,反应的热化学方程式表示为:2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H<0。
(4)①结合化学反应原理分析,该反应可自发进行的原因是___________ 。
②N2H4和N2O4作为火箭推进剂的主要原因是___________ 。
Ⅲ.肼可还原钴离子制备纳米金属钴,纳米金属钴具有特殊的物理、化学和表面性质。
(5)下列状态的钴中,电离最外层一个电子所需能量最小的是_______ 。
A.[Ar]3d74s2 B.[Ar]3d74s14p1 C.[Ar]3d74s1
(6)Co2+被N2H4还原的离子方程式如下,完成方程式并配平_______ 。
 Co2++
Co2++ N2H4+
N2H4+ ___________=
___________= Co↓+
Co↓+ N2↑+
N2↑+ H2O
H2O
当转移7.224×1024个电子数时,生成金属钴___________ 克。
(7)金属钴可以形成多种配合物。一种配合物由Co3+、NH3、Cl-、H2O组成,实验显示Co3+、NH3、Cl-、H2O的物质的量之比为1∶3∶3∶1.向该配合物的水溶液加入AgNO3溶液,只能沉淀出三分之一的Cl-。
①该配合物的化学式是___________ 。
A.[Co(NH3)3ClH2O]Cl2 B.[Co(NH3)3Cl2H2O]Cl C.[Co(NH3)3H2O]Cl3
②该配合物的配体有___________ 。
Ⅰ.N2H4分子中所有原子均达到稀有气体原子的稳定结构。
(1)写出N2H4的电子式。
(2)N2H4晶体受热熔化时,破坏的作用力有___________。
| A.范德华力 | B.氢键 | C.共价键 | D.离子键 |
①由N2H4+H2O
 N2H
N2H +OH- 可知N2H4是
+OH- 可知N2H4是A.酸 B.碱
②选择足量的盐酸或NaOH溶液与N2H4充分反应,生成盐的化学式为
Ⅱ.肼具有强还原性,可作火箭推进剂燃料,反应的热化学方程式表示为:2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H<0。
(4)①结合化学反应原理分析,该反应可自发进行的原因是
②N2H4和N2O4作为火箭推进剂的主要原因是
Ⅲ.肼可还原钴离子制备纳米金属钴,纳米金属钴具有特殊的物理、化学和表面性质。
(5)下列状态的钴中,电离最外层一个电子所需能量最小的是
A.[Ar]3d74s2 B.[Ar]3d74s14p1 C.[Ar]3d74s1
(6)Co2+被N2H4还原的离子方程式如下,完成方程式并配平
 Co2++
Co2++ N2H4+
N2H4+ ___________=
___________= Co↓+
Co↓+ N2↑+
N2↑+ H2O
H2O当转移7.224×1024个电子数时,生成金属钴
(7)金属钴可以形成多种配合物。一种配合物由Co3+、NH3、Cl-、H2O组成,实验显示Co3+、NH3、Cl-、H2O的物质的量之比为1∶3∶3∶1.向该配合物的水溶液加入AgNO3溶液,只能沉淀出三分之一的Cl-。
①该配合物的化学式是
A.[Co(NH3)3ClH2O]Cl2 B.[Co(NH3)3Cl2H2O]Cl C.[Co(NH3)3H2O]Cl3
②该配合物的配体有
您最近一年使用:0次
名校
4 . 自来水的硬度是指自来水中Ca的含量。用滴定法测定自来水的硬度的实验步骤如下:
①用移液管移取100.00mL自来水于250mL锥形瓶中(煮沸后冷却以除去溶解的CO2);
④用标准的EDTA溶液(用Na2H2 Y表示)滴定至终点,发生反应:H2Y2-+Ca2+=Ca(H2Y)。
(1)步骤②中的三乙醇胺是为了遮蔽自来水中其他会与EDTA配位的金属离子(如Fe3+等),形成如图所示的稳定配合物。下列说法正确的是___________。
(2)三乙醇胺与三价铁配位后,溶液的酸性___________ 。
A.增强 B.不变 C.减弱
NH3·H2O-NH4Cl缓冲液可维持滴定过程中溶液pH稳定,其原理是___________ 。
(3)铬黑T(如图)是一种金属离子指示剂,其本身为黑色粉末,水溶液显蓝色,下列关于铬黑T的说
法正确的是___________。
(4)判断滴定到达终点的依据是___________ 。
(5)滴定时使用标准0.0200mol/L的EDTA溶液,做三组平行实验,测得如下数据:
___________ 。
(6)计算自来水样品中钙离子的浓度。自来水中的Ca以CaCO3形式存在,我国规定生活用水的硬度 (CaCO3)不得超过450mg/L,判断该自来水硬度是否达标?(列式计算)
(CaCO3)不得超过450mg/L,判断该自来水硬度是否达标?(列式计算) ___________
①用移液管移取100.00mL自来水于250mL锥形瓶中(煮沸后冷却以除去溶解的CO2);
②加入3mL 三乙醇胺( )溶液与5mL NH3·H2O-NH4Cl缓冲液;
)溶液与5mL NH3·H2O-NH4Cl缓冲液;
④用标准的EDTA溶液(用Na2H2 Y表示)滴定至终点,发生反应:H2Y2-+Ca2+=Ca(H2Y)。
(1)步骤②中的三乙醇胺是为了遮蔽自来水中其他会与EDTA配位的金属离子(如Fe3+等),形成如图所示的稳定配合物。下列说法正确的是___________。

| A.三乙醇胺在核磁共振氢谱中只显示一组峰 | B.该配合物中的配位数与配体个数相等 |
| C.三乙醇胺不能与Ca2+和Mg2+配位 | D.该配合物只有内界,没有外界 |
(2)三乙醇胺与三价铁配位后,溶液的酸性
A.增强 B.不变 C.减弱
NH3·H2O-NH4Cl缓冲液可维持滴定过程中溶液pH稳定,其原理是
(3)铬黑T(如图)是一种金属离子指示剂,其本身为黑色粉末,水溶液显蓝色,下列关于铬黑T的说
法正确的是___________。
| 铬黑T 化学式:C20H12N3NaO7S 结构: |
| A.铬黑T中含有铬元素 | B.铬黑T与Ca2+、Fe3+均能显色 |
| C.可用红外光谱检验铬黑T中的官能团 | D.铬黑T能与NaHCO3反应放出CO2 |
(4)判断滴定到达终点的依据是
(5)滴定时使用标准0.0200mol/L的EDTA溶液,做三组平行实验,测得如下数据:
| 实验组号 | 1 | 2 | 3 |
| 消耗标准液的体积 | 20.02 | 19.98 | 如图所示 |

(6)计算自来水样品中钙离子的浓度。自来水中的Ca以CaCO3形式存在,我国规定生活用水的硬度
 (CaCO3)不得超过450mg/L,判断该自来水硬度是否达标?(列式计算)
(CaCO3)不得超过450mg/L,判断该自来水硬度是否达标?(列式计算)
您最近一年使用:0次
名校
5 . 铜盐颜色丰富。为了探究铜盐颜色的相关因素,进行下列实验:
【查阅资料】
固体铜盐的颜色与阴离子被极化能力有关,化学键共价性增强,吸收光的能量下降,颜色加深;在CuCl2溶液中存在如下平衡:
[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O
[CuCl4]2-+4H2O 
【设计方案】
实验温度:25℃(第1~7组);50℃(第8组)
试剂A:0.5 mol/LCuCl2(aq);试剂B:饱和CuSO4(aq);试剂C;试剂D:饱和NaCl(aq)
(1)从原子结构角度,解释CuBr2(s)的颜色比 CuCl2(s)深的原因___________ 。
(2)配制CuCl2(aq)的方法是___________ 。
(3)用“→”表示配位键,在下面框中画出[Cu(H2O)4]2+的结构式___________ 。___________ ,a=___________ ,△H___________ 0(选填“>”或“<”)。
(5)从平衡移动原理解释实验4和5中溶液颜色差异的原因___________ 。
(6)以上实验说明影响CuCl2(aq)颜色的因素主要有___________ 。
【查阅资料】
| 物质 | CuSO4(s) | CuCl2(s) | CuBr2(s) | CuSO4(aq) | CuBr2(aq) | CuCl2(aq)浓→稀 |
| 颜色 | 白 | 棕黄 | 棕褐 | 蓝 | 篮 | 黄绿→绿→蓝 |
[Cu(H2O)4]2++4Cl-
 [CuCl4]2-+4H2O
[CuCl4]2-+4H2O 
【设计方案】
实验温度:25℃(第1~7组);50℃(第8组)
试剂A:0.5 mol/LCuCl2(aq);试剂B:饱和CuSO4(aq);试剂C;试剂D:饱和NaCl(aq)
| 序号 | V(A)/mL | V(B)/mL | V(C)/mL | V(D)/mL | V(水)/mL | 溶液颜色 |
| 1 | 4.0 | 无色 | ||||
| 2 | 4.0 | 无色 | ||||
| 3 | 4.0 | 蓝色 | ||||
| 4 | 4.0 | 绿色 | ||||
| 5 | 2.0 | a | 蓝绿色 | |||
| 6 | 2.0 | 2.0 | 蓝绿色 | |||
| 7 | 2.0 | 2.0 | 黄绿色 | |||
| 8 | 4.0 | 黄绿色 |
(2)配制CuCl2(aq)的方法是
(3)用“→”表示配位键,在下面框中画出[Cu(H2O)4]2+的结构式

(5)从平衡移动原理解释实验4和5中溶液颜色差异的原因
(6)以上实验说明影响CuCl2(aq)颜色的因素主要有
您最近一年使用:0次
名校
6 . 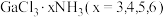 是一系列化合物,向含
是一系列化合物,向含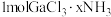 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有 氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为
氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为 。
。
(1) 分子的空间结构是三角锥形,
分子的空间结构是三角锥形, 的价层电子对的空间结构为_____。
的价层电子对的空间结构为_____。
(2)固态 晶体中含有的作用力有
晶体中含有的作用力有_____ 。
A. 非极性键 B. 极性键 C. 配位键
(3)能准确表示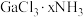 结构的化学式为
结构的化学式为_____ 。
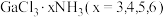 是一系列化合物,向含
是一系列化合物,向含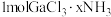 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有 氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为
氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为 。
。(1)
 分子的空间结构是三角锥形,
分子的空间结构是三角锥形, 的价层电子对的空间结构为_____。
的价层电子对的空间结构为_____。| A.直线形 | B.平面三角形 | C.三角锥形 | D.四面体形 |
 晶体中含有的作用力有
晶体中含有的作用力有A. 非极性键 B. 极性键 C. 配位键
(3)能准确表示
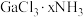 结构的化学式为
结构的化学式为
您最近一年使用:0次
名校
解题方法
7 . 硼酸(H3BO3)晶体结构为层状,其二维平面结构如图:______ mol氢键。
(2)硼酸是一元弱酸,它本身不给出H+,但与水作用后能给出H+。用离子方程式说明硼酸水溶液呈酸性的原因为_______ 。

(2)硼酸是一元弱酸,它本身不给出H+,但与水作用后能给出H+。用离子方程式说明硼酸水溶液呈酸性的原因为
您最近一年使用:0次
名校
解题方法
8 . 一种含Se的新型AIE分子(IV)的合成路线如图:_______ 。
(2)IV中具有孤电子对的原子有_______ 。
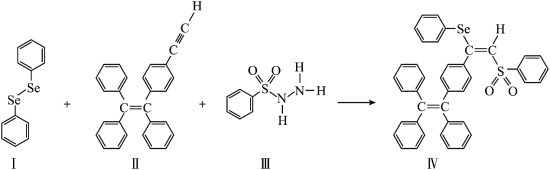
| A.I中仅有σ键 |
| B.I中的Se-Se为非极性共价键 |
| C.II易溶于水 |
| D.II中原子的杂化轨道类型只有sp、sp2、sp3 |
| A.C | B.O | C.S | D.Se |
您最近一年使用:0次
名校
解题方法
9 . 卤素互化物、拟卤素与卤素单质的结构,性质相似。常见的卤素互化物有ICl、IBr等,拟卤素有(CN)2、(SCN)2等。
(1)卤族元素位于元素周期表的_______ 。
(2)79Br和81Br这两种核素的中子数之差的绝对值为_______ 。
(3)①Cl2;②ICl;③IBr三种物质熔点由高到低的顺序为_______ 。
(4)①已知CN-与N2结构相似,CN-的电子式为______ 。
②推算HCN分子中σ键与π键数目之比为_______ 。
③关于氨基氰(N≡C-NH2)分子的说法中正确的是_______ 。
A.C原子采用sp3杂化
B.N原子的杂化形式有sp与sp3杂化
C.C≡N键的键长大于C-N键
D.所有原子满足8电子稳定结构
开采的金矿可用氰化法提取,步骤如下:
i.将金矿砂溶于pH为10.5~11的KCN溶液,并鼓入空气,过滤除去矿渣,得含K[Au(CN)2]的滤液;
ii.向滤液中加入足量金属锌,得单质金。Zn+2K[Au(CN)2]=2Au+K2[Zn(CN)4]
(5)K[Au(CN)2]中Au+的配体为______ 。
(6)K2[Zn(CN)4]中Au+的配位数为______ 。
(7)i中反应的离子方程式为:_______ 。
 Au+
Au+ CN-+
CN-+ _______+
_______+ _______=
_______= [Au(CN)2]-+
[Au(CN)2]-+ _______
_______
(8)已知Ka(HCN)=4.0×10-10。i中,pH<10.5会导致相同时间内Au的浸取率下降,原因_______ 。
(1)卤族元素位于元素周期表的
| A.s区 | B.p区 | C.d区 | D.f区 |
(3)①Cl2;②ICl;③IBr三种物质熔点由高到低的顺序为
| A.①>②>③ | B.③>②>① | C.②>①>③ | D.③>①>② |
②推算HCN分子中σ键与π键数目之比为
③关于氨基氰(N≡C-NH2)分子的说法中正确的是
A.C原子采用sp3杂化
B.N原子的杂化形式有sp与sp3杂化
C.C≡N键的键长大于C-N键
D.所有原子满足8电子稳定结构
开采的金矿可用氰化法提取,步骤如下:
i.将金矿砂溶于pH为10.5~11的KCN溶液,并鼓入空气,过滤除去矿渣,得含K[Au(CN)2]的滤液;
ii.向滤液中加入足量金属锌,得单质金。Zn+2K[Au(CN)2]=2Au+K2[Zn(CN)4]
(5)K[Au(CN)2]中Au+的配体为
(6)K2[Zn(CN)4]中Au+的配位数为
(7)i中反应的离子方程式为:
 Au+
Au+ CN-+
CN-+ _______+
_______+ _______=
_______= [Au(CN)2]-+
[Au(CN)2]-+ _______
_______(8)已知Ka(HCN)=4.0×10-10。i中,pH<10.5会导致相同时间内Au的浸取率下降,原因
您最近一年使用:0次
10 . 铜及其化合物在生产和生活中有着广泛的应用。
(1)Cu在元素周期表中的位置为______ 。
(2)基态铜原子有______ 种运动状态不同的电子。
(3)原子核外电子的两种自旋状态分别用+ 和-
和- 表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为______ 。
(4)Cu+比Cu2+更稳定的原因是_______ 。
Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如表实验。
(5)步骤I中反应的离子方程式为________ ;_______ 。
(6)H-N-H键角大小:[Cu(NH3)4]2+_______ NH3(填“>”、“=”或“<”),其原因是_______ 。
(7)该实验能说明,Cu2+与NH3的结合能力_______ (填“大于”“小于”或“等于”)Cu2+与OH-的结合能力。
(8)Cu2+能与乙二胺(H2NCH2CH2NH2)形成[Cu(H2NCH2CH2NH2)2]2+离子,结构如图,关于该配离子的说法正确的是______ 。
(1)Cu在元素周期表中的位置为
(2)基态铜原子有
(3)原子核外电子的两种自旋状态分别用+
 和-
和- 表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为(4)Cu+比Cu2+更稳定的原因是
Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如表实验。
| 序号 | 实验步骤 | 实验现象或结论 |
| I | 向CuSO4溶液中逐滴加入氨水至过量 | 产生蓝色沉淀,随后溶解并得到深蓝色的溶液 |
| Ⅱ | 再加入无水乙醇 | 得到深蓝色晶体 |
| Ⅲ | 测定深蓝色晶体的结构 | 晶体的化学式为[Cu(NH3)4]SO4 H2O H2O |
| Ⅳ | 将深蓝色晶体洗净后溶于水配成溶液,再加入稀NaOH溶液 | 无蓝色沉淀生成 |
(5)步骤I中反应的离子方程式为
(6)H-N-H键角大小:[Cu(NH3)4]2+
(7)该实验能说明,Cu2+与NH3的结合能力
(8)Cu2+能与乙二胺(H2NCH2CH2NH2)形成[Cu(H2NCH2CH2NH2)2]2+离子,结构如图,关于该配离子的说法正确的是
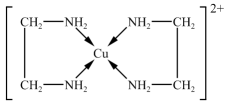
| A.该离子的配位数是4 |
| B.该离子的配体数是4 |
| C.形成配离子前后,Cu的化合价不变 |
| D.该离子中含有离子键、非极性键与极性键 |
您最近一年使用:0次




