名校
解题方法
1 . 矾是一些金属硫酸盐的统称,其中皓矾的化学式为 ,可用作媒染剂、木材防腐剂。下图是
,可用作媒染剂、木材防腐剂。下图是 的结构示意图:
的结构示意图: 离子。
离子。
1. 分子的分子构型为
分子的分子构型为___________ ,中心原子杂化方式为___________ 杂化。
2. 的沸点
的沸点___________ (填>、<或=)水的沸点,原因可能是___________ 。
3. 中,
中, 与
与 间的作用力为
间的作用力为___________ , 与
与 间的作用力为
间的作用力为___________ 。
4. 与
与 中的中心原子均为
中的中心原子均为 杂化,
杂化, 中H—O—H键角
中H—O—H键角___________ (填>、<或=) 中O—S—O键角,原因是
中O—S—O键角,原因是___________ 。
5.写出 溶于氨水的化学方程式
溶于氨水的化学方程式___________ 。
6. 受热失水时,随着温度的升高,先失去一个水分子,变为
受热失水时,随着温度的升高,先失去一个水分子,变为 ,再失去其它的水,首先失去的水分子应为
,再失去其它的水,首先失去的水分子应为___________ (填①或②),原因是___________ 。
 ,可用作媒染剂、木材防腐剂。下图是
,可用作媒染剂、木材防腐剂。下图是 的结构示意图:
的结构示意图: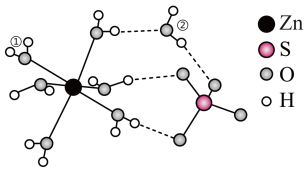
 离子。
离子。1.
 分子的分子构型为
分子的分子构型为2.
 的沸点
的沸点3.
 中,
中, 与
与 间的作用力为
间的作用力为 与
与 间的作用力为
间的作用力为4.
 与
与 中的中心原子均为
中的中心原子均为 杂化,
杂化, 中H—O—H键角
中H—O—H键角 中O—S—O键角,原因是
中O—S—O键角,原因是5.写出
 溶于氨水的化学方程式
溶于氨水的化学方程式6.
 受热失水时,随着温度的升高,先失去一个水分子,变为
受热失水时,随着温度的升高,先失去一个水分子,变为 ,再失去其它的水,首先失去的水分子应为
,再失去其它的水,首先失去的水分子应为
您最近一年使用:0次
解题方法
2 . 蛋氨酸铜的结构式如图。
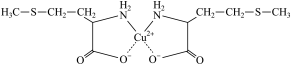
| A.配位键 | B.氢键 | C.离子键 | D.金属键 |
您最近一年使用:0次
解题方法
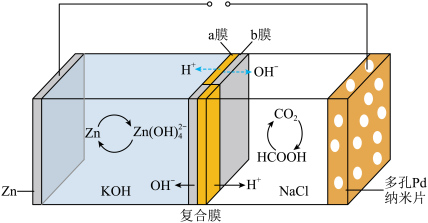
3 . 我国科学家研发的水系可逆Zn-CO2电池可吸收利用CO2.将两组正离子、负离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的H2O解离成H+和OH—,工作原理如图所示:_____ 。
(2)充电时复合膜中向多孔Pd纳米片极移动的离子是_____ ,放电时正极的电极反应式为_____ 。
(3)下列说法中正确的是_____。
(2)充电时复合膜中向多孔Pd纳米片极移动的离子是
(3)下列说法中正确的是_____。
| A.放电时锌做阳极 |
| B.充电时多孔Pd纳米片极发生还原反应 |
| C.Na2[Zn(OH)4]中只存在离子键和配位键 |
D.Zn(OH) 可在足量稀硫酸中转化为Zn2+ 可在足量稀硫酸中转化为Zn2+ |
您最近一年使用:0次
解题方法
4 . 硅材料在生活中占有重要地位。
(1)太阳能电池板主要材料为单晶硅或多晶硅。硅原子核外未成对电子数为___________ 。单晶硅的晶体类型为___________ 。
A.离子晶体 B.分子晶体 C.共价晶体 D.金属晶体
(2)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、②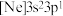 、③
、③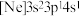 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(3)硅和卤素单质反应可以得到 ,
, 的熔沸点如下表:
的熔沸点如下表:
①气态 分子的空间构型是
分子的空间构型是___________ 。
A.正四面体形 B.三角锥形 C.角形 D.直线形
②0℃时, 、
、 、
、 、
、 呈液态的是
呈液态的是___________ 。
A. B.
B. C.
C. D.
D.
③比较上述 的熔沸点,分析其变化规律及原因
的熔沸点,分析其变化规律及原因___________ 。
(4) 与N-甲基咪唑
与N-甲基咪唑 反应可以得到
反应可以得到 ,其结构如下图所示:
,其结构如下图所示:___________ 。
(5)硅合金具有良好的性能。
①下列关于合金的说法错误的是___________ 。
A.熔点高于组成金属 B.可能含有非金属
C.硬度通常比组成金属大 D.一般比单一金属用途更广
②白铜是我国使用最早的合金之一,白铜晶胞结构如图所示(Cu位于面心),该晶胞含有的Cu原子和Ni原子个数分别为___________ 、___________ 。已知晶体密度为dg·cm-3,设NA为阿伏加德罗常数的值。Ni和Ni之间的最短距离为___________ nm。
(1)太阳能电池板主要材料为单晶硅或多晶硅。硅原子核外未成对电子数为
A.离子晶体 B.分子晶体 C.共价晶体 D.金属晶体
(2)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、②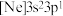 、③
、③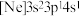 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.得电子能力:①>② |
| B.微粒半径:③>①>② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.电子排布属于基态原子(或离子)的是:①② |
 ,
, 的熔沸点如下表:
的熔沸点如下表: |  |  |  | |
| 熔点/℃ | -90.0 | -69.8 | 5.6 | 120.7 |
| 沸点/℃ | -85.8 | 57.8 | 154.2 | 287.7 |
 分子的空间构型是
分子的空间构型是A.正四面体形 B.三角锥形 C.角形 D.直线形
②0℃时,
 、
、 、
、 、
、 呈液态的是
呈液态的是A.
 B.
B. C.
C. D.
D.
③比较上述
 的熔沸点,分析其变化规律及原因
的熔沸点,分析其变化规律及原因(4)
 与N-甲基咪唑
与N-甲基咪唑 反应可以得到
反应可以得到 ,其结构如下图所示:
,其结构如下图所示:
(5)硅合金具有良好的性能。
①下列关于合金的说法错误的是
A.熔点高于组成金属 B.可能含有非金属
C.硬度通常比组成金属大 D.一般比单一金属用途更广
②白铜是我国使用最早的合金之一,白铜晶胞结构如图所示(Cu位于面心),该晶胞含有的Cu原子和Ni原子个数分别为

您最近一年使用:0次
解题方法
5 . 联氨(N2H4)又称肼,在航天、能源等领域具有广泛应用。
Ⅰ.N2H4分子中所有原子均达到稀有气体原子的稳定结构。
(1)写出N2H4的电子式。___________
(2)N2H4晶体受热熔化时,破坏的作用力有___________。
(3)酸碱质子理论提出:凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱。
①由N2H4+H2O N2H
N2H +OH- 可知N2H4是
+OH- 可知N2H4是___________ 。
A.酸 B.碱
②选择足量的盐酸或NaOH溶液与N2H4充分反应,生成盐的化学式为___________ 。
Ⅱ.肼具有强还原性,可作火箭推进剂燃料,反应的热化学方程式表示为:2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H<0。
(4)①结合化学反应原理分析,该反应可自发进行的原因是___________ 。
②N2H4和N2O4作为火箭推进剂的主要原因是___________ 。
Ⅲ.肼可还原钴离子制备纳米金属钴,纳米金属钴具有特殊的物理、化学和表面性质。
(5)下列状态的钴中,电离最外层一个电子所需能量最小的是_______ 。
A.[Ar]3d74s2 B.[Ar]3d74s14p1 C.[Ar]3d74s1
(6)Co2+被N2H4还原的离子方程式如下,完成方程式并配平_______ 。
 Co2++
Co2++ N2H4+
N2H4+ ___________=
___________= Co↓+
Co↓+ N2↑+
N2↑+ H2O
H2O
当转移7.224×1024个电子数时,生成金属钴___________ 克。
(7)金属钴可以形成多种配合物。一种配合物由Co3+、NH3、Cl-、H2O组成,实验显示Co3+、NH3、Cl-、H2O的物质的量之比为1∶3∶3∶1.向该配合物的水溶液加入AgNO3溶液,只能沉淀出三分之一的Cl-。
①该配合物的化学式是___________ 。
A.[Co(NH3)3ClH2O]Cl2 B.[Co(NH3)3Cl2H2O]Cl C.[Co(NH3)3H2O]Cl3
②该配合物的配体有___________ 。
Ⅰ.N2H4分子中所有原子均达到稀有气体原子的稳定结构。
(1)写出N2H4的电子式。
(2)N2H4晶体受热熔化时,破坏的作用力有___________。
| A.范德华力 | B.氢键 | C.共价键 | D.离子键 |
①由N2H4+H2O
 N2H
N2H +OH- 可知N2H4是
+OH- 可知N2H4是A.酸 B.碱
②选择足量的盐酸或NaOH溶液与N2H4充分反应,生成盐的化学式为
Ⅱ.肼具有强还原性,可作火箭推进剂燃料,反应的热化学方程式表示为:2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H<0。
(4)①结合化学反应原理分析,该反应可自发进行的原因是
②N2H4和N2O4作为火箭推进剂的主要原因是
Ⅲ.肼可还原钴离子制备纳米金属钴,纳米金属钴具有特殊的物理、化学和表面性质。
(5)下列状态的钴中,电离最外层一个电子所需能量最小的是
A.[Ar]3d74s2 B.[Ar]3d74s14p1 C.[Ar]3d74s1
(6)Co2+被N2H4还原的离子方程式如下,完成方程式并配平
 Co2++
Co2++ N2H4+
N2H4+ ___________=
___________= Co↓+
Co↓+ N2↑+
N2↑+ H2O
H2O当转移7.224×1024个电子数时,生成金属钴
(7)金属钴可以形成多种配合物。一种配合物由Co3+、NH3、Cl-、H2O组成,实验显示Co3+、NH3、Cl-、H2O的物质的量之比为1∶3∶3∶1.向该配合物的水溶液加入AgNO3溶液,只能沉淀出三分之一的Cl-。
①该配合物的化学式是
A.[Co(NH3)3ClH2O]Cl2 B.[Co(NH3)3Cl2H2O]Cl C.[Co(NH3)3H2O]Cl3
②该配合物的配体有
您最近一年使用:0次
名校
6 . 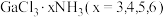 是一系列化合物,向含
是一系列化合物,向含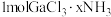 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有 氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为
氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为 。
。
(1) 分子的空间结构是三角锥形,
分子的空间结构是三角锥形, 的价层电子对的空间结构为_____。
的价层电子对的空间结构为_____。
(2)固态 晶体中含有的作用力有
晶体中含有的作用力有_____ 。
A. 非极性键 B. 极性键 C. 配位键
(3)能准确表示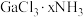 结构的化学式为
结构的化学式为_____ 。
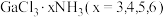 是一系列化合物,向含
是一系列化合物,向含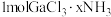 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有 氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为
氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为 。
。(1)
 分子的空间结构是三角锥形,
分子的空间结构是三角锥形, 的价层电子对的空间结构为_____。
的价层电子对的空间结构为_____。| A.直线形 | B.平面三角形 | C.三角锥形 | D.四面体形 |
 晶体中含有的作用力有
晶体中含有的作用力有A. 非极性键 B. 极性键 C. 配位键
(3)能准确表示
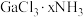 结构的化学式为
结构的化学式为
您最近一年使用:0次
7 . 铜及其化合物在生产和生活中有着广泛的应用。
(1)Cu在元素周期表中的位置为______ 。
(2)基态铜原子有______ 种运动状态不同的电子。
(3)原子核外电子的两种自旋状态分别用+ 和-
和- 表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为______ 。
(4)Cu+比Cu2+更稳定的原因是_______ 。
Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如表实验。
(5)步骤I中反应的离子方程式为________ ;_______ 。
(6)H-N-H键角大小:[Cu(NH3)4]2+_______ NH3(填“>”、“=”或“<”),其原因是_______ 。
(7)该实验能说明,Cu2+与NH3的结合能力_______ (填“大于”“小于”或“等于”)Cu2+与OH-的结合能力。
(8)Cu2+能与乙二胺(H2NCH2CH2NH2)形成[Cu(H2NCH2CH2NH2)2]2+离子,结构如图,关于该配离子的说法正确的是______ 。
(1)Cu在元素周期表中的位置为
(2)基态铜原子有
(3)原子核外电子的两种自旋状态分别用+
 和-
和- 表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为(4)Cu+比Cu2+更稳定的原因是
Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如表实验。
| 序号 | 实验步骤 | 实验现象或结论 |
| I | 向CuSO4溶液中逐滴加入氨水至过量 | 产生蓝色沉淀,随后溶解并得到深蓝色的溶液 |
| Ⅱ | 再加入无水乙醇 | 得到深蓝色晶体 |
| Ⅲ | 测定深蓝色晶体的结构 | 晶体的化学式为[Cu(NH3)4]SO4 H2O H2O |
| Ⅳ | 将深蓝色晶体洗净后溶于水配成溶液,再加入稀NaOH溶液 | 无蓝色沉淀生成 |
(5)步骤I中反应的离子方程式为
(6)H-N-H键角大小:[Cu(NH3)4]2+
(7)该实验能说明,Cu2+与NH3的结合能力
(8)Cu2+能与乙二胺(H2NCH2CH2NH2)形成[Cu(H2NCH2CH2NH2)2]2+离子,结构如图,关于该配离子的说法正确的是
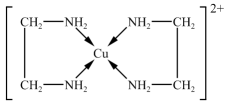
| A.该离子的配位数是4 |
| B.该离子的配体数是4 |
| C.形成配离子前后,Cu的化合价不变 |
| D.该离子中含有离子键、非极性键与极性键 |
您最近一年使用:0次
8 . 镍颜色近似银白色,我国古时使用 “白铜”(一种镍铜合金)制造兵器。现代工业镍及其化合物主要用于生产不锈钢、电池以及催化剂领域。
(1)基态镍原子的价电子排布式为___________ ,镍元素在周期表中的位置为___________ 。
(2)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示,该合金的化学式为___________。

(3)已知NiO、FeO的晶体结构类型均与氯化钠相同,Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO___________ FeO(选填“<””或“>”),理由是___________ 。
(4)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示,下列关于该配合物结构分析正确的是__________。

(5)镍镉(Ni-Cd)可充电电池应用广泛。已知某镍镉电池的电解质溶液为KOH溶液,其充电和放电的反应原理为:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2,有关该电池的说法正确的是_______。
Cd(OH)2+2Ni(OH)2,有关该电池的说法正确的是_______。
(6)工业上通过调节pH除杂并回收废液中的镍,用于制备硫酸镍晶体。常温下,加碱调节pH在7.2~8.7,使Ni2+开始沉淀,至其浓度降为1.0×10−5 mol·L-1,可认为Ni2+已经完全沉淀,则Ni(OH)2的Ksp=___________ 。
(7)硫酸镍溶液在强碱中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式___________ 。
(8)将分离出硫酸镍晶体后的母液收集、循环使用。其主要目的是___________ 。
(1)基态镍原子的价电子排布式为
(2)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示,该合金的化学式为___________。

| A.LaNi5 | B.LaNi6 | C.LaNi8 | D.LaNi9 |
(3)已知NiO、FeO的晶体结构类型均与氯化钠相同,Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO
(4)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示,下列关于该配合物结构分析正确的是__________。

| A.配体的分子式为C8H14N4O4 |
| B.既有内界,又有外界 |
| C.配位数为4 |
| D.氧原子与氢原子之间形成的化学键有共价键和氢键 |
(5)镍镉(Ni-Cd)可充电电池应用广泛。已知某镍镉电池的电解质溶液为KOH溶液,其充电和放电的反应原理为:Cd+2NiOOH+2H2O
 Cd(OH)2+2Ni(OH)2,有关该电池的说法正确的是_______。
Cd(OH)2+2Ni(OH)2,有关该电池的说法正确的是_______。| A.充电时阳极反应:Ni(OH)2+OH——e—=NiOOH+H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时OH—向正极移动 |
(6)工业上通过调节pH除杂并回收废液中的镍,用于制备硫酸镍晶体。常温下,加碱调节pH在7.2~8.7,使Ni2+开始沉淀,至其浓度降为1.0×10−5 mol·L-1,可认为Ni2+已经完全沉淀,则Ni(OH)2的Ksp=
(7)硫酸镍溶液在强碱中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(8)将分离出硫酸镍晶体后的母液收集、循环使用。其主要目的是
您最近一年使用:0次
名校
解题方法
9 .  (二氯化一氯五氨合钴)是一种易溶于热水、常温下难溶于水和乙醇的紫红色晶体。因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注。
(二氯化一氯五氨合钴)是一种易溶于热水、常温下难溶于水和乙醇的紫红色晶体。因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注。
某化学兴趣小组完成了部分该实验的实验报告:
Ⅰ.将适量氯化铵溶于浓氨水中,充分搅拌下,分批次加入 晶体,得到
晶体,得到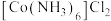 沉淀。
沉淀。
Ⅱ.边搅拌边慢慢滴入足量 溶液,得到
溶液,得到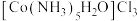 溶液。
溶液。
Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到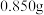 产品。
产品。
查阅资料显示: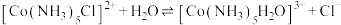
二、实验装置(部分)
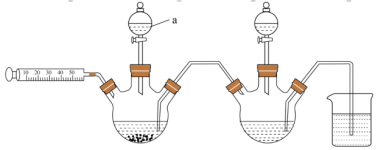
三、实验反思
(1)仪器a的名称是________ 。
(2)本实验涉及钴配合物的配体有________________ (填化学式),步骤Ⅱ所得钴配合物溶液中外界离子的检验方法是__________________________________________________ 。
(3)本实验应在通风橱中进行,原因是___________________________________ 。
(4)步骤Ⅰ中分批次加入 晶体,原因是
晶体,原因是________________________ 。
(5)步骤Ⅱ中加入双氧水的目的是________________________ ;步骤Ⅲ中加入适量浓盐酸的目的是______________________ 。
(6)步骤Ⅳ洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中,乙醇洗涤的目的是__________________ 。
四、数据处理
评分标准:(已知:产率 )
)
(7)通过计算判断该兴趣小组本次实验的评分等第_______ 。(写出计算过程)
 (二氯化一氯五氨合钴)是一种易溶于热水、常温下难溶于水和乙醇的紫红色晶体。因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注。
(二氯化一氯五氨合钴)是一种易溶于热水、常温下难溶于水和乙醇的紫红色晶体。因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注。某化学兴趣小组完成了部分该实验的实验报告:
化学实验报告
题目:制备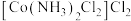
Ⅰ.将适量氯化铵溶于浓氨水中,充分搅拌下,分批次加入
 晶体,得到
晶体,得到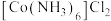 沉淀。
沉淀。Ⅱ.边搅拌边慢慢滴入足量
 溶液,得到
溶液,得到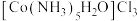 溶液。
溶液。Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到
 产品。
产品。查阅资料显示:
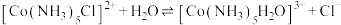
二、实验装置(部分)

三、实验反思
(1)仪器a的名称是
(2)本实验涉及钴配合物的配体有
(3)本实验应在通风橱中进行,原因是
(4)步骤Ⅰ中分批次加入
 晶体,原因是
晶体,原因是(5)步骤Ⅱ中加入双氧水的目的是
(6)步骤Ⅳ洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中,乙醇洗涤的目的是
四、数据处理
评分标准:(已知:产率
 )
)| 产率 |  |  |  |
| 评分等第 | 需努力 | 良好 | 优秀 |
(7)通过计算判断该兴趣小组本次实验的评分等第
您最近一年使用:0次
名校
解题方法
10 . 硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为(ZnCO3),杂质为MnO、FeO、Fe2O3、SiO2等。其制备流程如下:
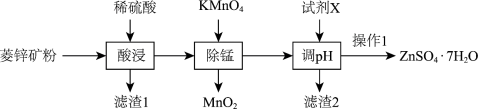
已知:①MnO 不溶于水,可溶于酸;
②通常认为残留在溶液中的离子浓度小于1×10-5 mol/L 时即为除杂完全;
③本题中所涉及离子的氢氧化物溶度积常数如下表:
(1)已知Zn2+可形成[Zn(NH3)4]2+,该配离子中提供空轨道的是___________ ,配位数是___________ 。
(2)除了“除锰”,KMnO4还有什么作用:___________ 。
(3)加入试剂 X 可调溶液pH,若 c(Zn2+)=1.0mol/L,则溶液pH的范围是___________ (保留一位小数);最适宜使用的试剂X是___________ 。
A.NaOH B.氨水 C.CuO D.ZnO
(4)“操作1”具体包括加热浓缩、___________ 、___________ 、洗涤干燥。
(5)已知Ksp(ZnS)=1.6×10-26,H2S的Ka1=1.1×10-7、Ka2=7.1×10-15。请通过计算判断能否通过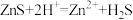 (一般认为K>105即该反应正向进行程度较大)
(一般认为K>105即该反应正向进行程度较大)___________ 。

已知:①MnO 不溶于水,可溶于酸;
②通常认为残留在溶液中的离子浓度小于1×10-5 mol/L 时即为除杂完全;
③本题中所涉及离子的氢氧化物溶度积常数如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| Ksp | 1×10-38 | 8×10-16 | 2×10-20 | 1×10-17 |
(1)已知Zn2+可形成[Zn(NH3)4]2+,该配离子中提供空轨道的是
(2)除了“除锰”,KMnO4还有什么作用:
(3)加入试剂 X 可调溶液pH,若 c(Zn2+)=1.0mol/L,则溶液pH的范围是
A.NaOH B.氨水 C.CuO D.ZnO
(4)“操作1”具体包括加热浓缩、
(5)已知Ksp(ZnS)=1.6×10-26,H2S的Ka1=1.1×10-7、Ka2=7.1×10-15。请通过计算判断能否通过
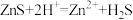 (一般认为K>105即该反应正向进行程度较大)
(一般认为K>105即该反应正向进行程度较大)
您最近一年使用:0次



