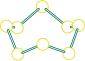
1 . “暖冰技术”的原理:在强电场作用下使液态水瞬间凝固结晶。目前科学家们已经成功地制造出了“室温冰”,称为“暖冰”。下列关于“暖冰”的说法中正确的是
| A.“暖冰”的熔点升高,“暖冰”属于原子晶体 |
| B.“暖冰”分子与干冰分子的空间结构相同 |
C.“暖冰”分子可能与 分子的极性相同 分子的极性相同 |
| D.在强电场作用下,水分子间更易形成分子间氢键,因而可制得“暖冰” |
您最近一年使用:0次
2022-12-13更新
|
180次组卷
|
2卷引用:黑龙江省海伦市第二中学2022-2023学年高三上学期期末考试化学试题
名校
解题方法
2 . 下列物质中,由极性键构成的非极性分子是
A. | B. | C. | D. |
您最近一年使用:0次
2023-02-19更新
|
160次组卷
|
2卷引用:黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二下学期7月期末考试化学试题
9-10高二·黑龙江·阶段练习
名校
解题方法
3 . 关于CS2,SO2,NH3三种物质的说法中正确的是( )
| A.CS2在水中的溶解度很小,是由于其属于极性分子 |
| B.SO2和NH3均易溶于水,原因之一是它们都是极性分子 |
| C.CS2为非极性分子,所以在三种物质中熔、沸点最低 |
| D.NH3在水中溶解度很大只是由于NH3分子有极性 |
您最近一年使用:0次
2020-11-05更新
|
672次组卷
|
32卷引用:2009-2010学年黑龙江佳一中高二第三学段考试化学试卷(选修3)
(已下线)2009-2010学年黑龙江佳一中高二第三学段考试化学试卷(选修3)【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期4月月考化学试题2014-2015湖北省襄阳市襄州一中等四校高二下学期期中联考化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.3 第2课时(已下线)2018年11月30日 《每日一题》一轮复习-键的极性与分子的极性云南省巧家县四中2018-2019学年高二上学期12月份考试化学试题云南省新平县一中2018-2019学年高二上学期12月考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题云南省玉溪市江川二中2018-2019学年高二下学期开学考试化学试题(已下线)2019年3月24日 《每日一题》选修3-每周一测(已下线)2019年6月12日 《每日一题》 选修3-物质类别、键的极性及分子的极性之间的关系宁夏银川市银川二中2019-2020学年高二上学期第一次月考化学试题云南省云龙县第二中学2019-2020学年高二上学期期末考试化学试题云南省河口县高级中学2019-2020学年高二上学期期末考试化学试题第2章 化学键与分子间作用力——B拓展区综合拓展(鲁科版选修3)山西省太原市阳曲县第一中学2019-2020学年高二5月复学检测化学试题安徽省亳州市涡阳县第九中学2019-2020学年高二下学期期末考试化学试题(已下线)第35讲 分子结构与性质-2021年高考化学一轮复习名师精讲练广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题四川省阿坝州九寨沟2019-2020学年高二上学期期末考试化学试题(已下线)第16单元 物质的结构与性质(选考)(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(人教版2019)选择性必修2 第二章 分子结构与性质 第三节 分子结构与物质的性质 课时3 溶解性 手性(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第41练 分子结构与物质的性质-2023年高考化学一轮复习小题多维练(全国通用)广东省潮州湘桥区南春中学2021-2022学年高二下学期第一次月考化学试题吉林省长春市综合实验中学2021-2022学年高二上学期期末考试化学试题 广东省佛山市顺德区罗定邦中学2022-2023学年高二下学期3月第一次月考化学试题广东省茂名化州市第三中学2021-2022学年高二下学期3月月考化学试题(已下线)考点42 分子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)云南省大理州实验中学2021-2022学年高二下学期化学期中考试题
名校
4 . 下列叙述不正确的是
| A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强 |
| B.以极性键结合的分子,不一定是极性分子 |
| C.判断A2B或AB2型分子是极性分子的依据是:具有极性键且分子构型不对称,键角小于180°,为非直线形结构 |
| D.非极性分子中,各原子间都应以非极性键结合 |
您最近一年使用:0次
2018-06-30更新
|
1080次组卷
|
9卷引用:【全国百强校】黑龙江省大庆市铁人中学2017-2018学年高二下学期期中考试化学试题
【全国百强校】黑龙江省大庆市铁人中学2017-2018学年高二下学期期中考试化学试题云南省澄江二中2018-2019学年高二上学期期中考试化学试题甘肃省庆阳市镇原中学2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第三节 分子结构与物质的性质 易错疑难集训(三)第三节 分子结构与物质的性质 第1课时 共价键的极性安徽省滁州市定远县民族中学2021-2022学年高二下学期期中考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章01讲核心2.2.2分子的空间结构与分子性质(课前)-鲁科版选择性必修22.3.1 共价键的极性-随堂练习
名校
解题方法
5 . 下列说法中正确的是
①在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
②同一周期从左到右,元素的第一电离能、电负性都是越来越大
③PCl3和光气(COCl2)分子中所有原子的最外层都达到8电子稳定结构
④所有的配合物都存在配位键,所有含配位键的化合物都是配合物
⑤所有含极性键的分子都是极性分子
⑥熔融状态下能导电的化合物一定是离子化合物
⑦所有的原子晶体都不导电
①在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
②同一周期从左到右,元素的第一电离能、电负性都是越来越大
③PCl3和光气(COCl2)分子中所有原子的最外层都达到8电子稳定结构
④所有的配合物都存在配位键,所有含配位键的化合物都是配合物
⑤所有含极性键的分子都是极性分子
⑥熔融状态下能导电的化合物一定是离子化合物
⑦所有的原子晶体都不导电
| A.①② | B.④⑥ | C.③⑥ | D.③⑦ |
您最近一年使用:0次
2021-03-18更新
|
365次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2020-2021学年高二4月月考化学试题
名校
6 . 下列说法中正确的是
| A.气体单质中,一定有σ 键,可能有π 键 |
| B.PCl3分子是非极性分子 |
| C.甲醛(HCHO)、苯和二氧化碳中碳原子均采用 sp2杂化 |
D. 的 VSEPR 模型与离子的空间立体构型一致 的 VSEPR 模型与离子的空间立体构型一致 |
您最近一年使用:0次
2020-09-01更新
|
483次组卷
|
2卷引用:黑龙江省哈尔滨市宾县第二中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
7 . 下列说法中正确的是
| A.CH4、C2H4、HCN都是含有极性键的非极性分子 |
B. 与 与 的立体构型相似,都是非极性分子 的立体构型相似,都是非极性分子 |
C.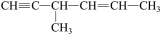 分子中含有 分子中含有 个手性碳原子 个手性碳原子 |
D. 键的电子云图形是镜面对称的,而 键的电子云图形是镜面对称的,而 键的电子云图形是轴对称的 键的电子云图形是轴对称的 |
您最近一年使用:0次
名校
8 .  和CO是污染性气体,可在
和CO是污染性气体,可在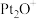 表面转化为无害气体,有关化学反应的物质变化过程如图1所示,总反应的能量变化过程如图2所示,下列说法正确的是
表面转化为无害气体,有关化学反应的物质变化过程如图1所示,总反应的能量变化过程如图2所示,下列说法正确的是
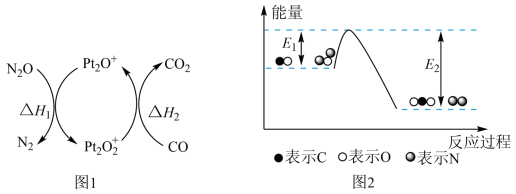
 和CO是污染性气体,可在
和CO是污染性气体,可在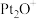 表面转化为无害气体,有关化学反应的物质变化过程如图1所示,总反应的能量变化过程如图2所示,下列说法正确的是
表面转化为无害气体,有关化学反应的物质变化过程如图1所示,总反应的能量变化过程如图2所示,下列说法正确的是
A.总反应的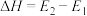 |
B.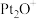 降低了总反应的焓变 降低了总反应的焓变 |
| C.总反应中氧化剂和还原剂的物质的量之比为2:1 |
D. 、 、 均为非极性分子 均为非极性分子 |
您最近一年使用:0次
2023-11-10更新
|
141次组卷
|
2卷引用:黑龙江省大庆铁人中学2023-2024学年高三上学期期中考试化学试题
名校
9 . 工业上制备纯碱的原理为:NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3,请回答下列问题:
(1)上述反应体系中出现的几种短周期元素中,第二周期元素原子半径由大到小的顺序是___________ 。
(2)反应体系中出现的非金属元素,可形成多种化合物,其中和铵根离子空间构型相同,且属于有机物的电子式是___________ ,该分子为___________ (填“极性”或“非极性”)分子。
(3)化合物FeF3熔点高于1000℃而Fe(CO)5的熔点却低于0℃,FeF3熔点远高于Fe(CO)5的原因可能是___________ 。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。
①FeO立方晶胞结构如图甲所示,则Fe2+的配位数为___________ ,与O2-紧邻的所有Fe2+构成的几何构型为___________ 。
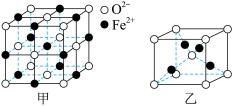
②Cu2O立方晶胞结构如图乙所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________ g·cm-3(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)。
(1)上述反应体系中出现的几种短周期元素中,第二周期元素原子半径由大到小的顺序是
(2)反应体系中出现的非金属元素,可形成多种化合物,其中和铵根离子空间构型相同,且属于有机物的电子式是
(3)化合物FeF3熔点高于1000℃而Fe(CO)5的熔点却低于0℃,FeF3熔点远高于Fe(CO)5的原因可能是
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。
①FeO立方晶胞结构如图甲所示,则Fe2+的配位数为

②Cu2O立方晶胞结构如图乙所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为
您最近一年使用:0次
2023-11-10更新
|
140次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
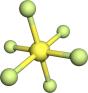
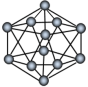
10 . 观察下列模型并结合有关信息进行判断,下列说法错误 的是
 |  |  (正八面体) (正八面体) | 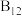 结构单元 结构单元 | |
| 结构模型示意图 |
|
|
|
|
A. 的结构式为 的结构式为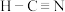 | B.固态硫 属于共价晶体 属于共价晶体 |
C. 是由极性键构成的非极性分子 是由极性键构成的非极性分子 | D.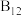 结构单元含 结构单元含 键30个 键30个 |
您最近一年使用:0次
2023-09-09更新
|
119次组卷
|
3卷引用:黑龙江省牡丹江市第二高级中学2023-2024学年高二下学期4月月考化学试卷