名校
1 . 下列说法正确的是
| A.可以利用质谱仪测得某未知物的结构 |
| B.区别晶体与非晶体最科学的方法是对固体进行X射线衍射实验 |
C.可燃冰 中甲烷分子和水分子间形成了氢键 中甲烷分子和水分子间形成了氢键 |
| D.臭氧分子是非极性分子 |
您最近一年使用:0次
2023-03-01更新
|
329次组卷
|
3卷引用:黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题
名校
解题方法
2 . 生产生活中处处有化学,结合物质与结构的相关知识,回答下列问题:
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示
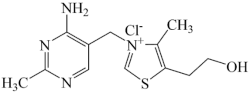
①C元素基态原子核外电子有_______ 种运动状态,其中电子占据能量最高的能级符号为_______ 。
②维生素B1晶体溶于水的过程中要克服的微粒间的作用力有_______ 。(填序号)
a.离子键、共价键 b.离子键、氢键、共价键
c.氢键、范德华力 d.离子键、氢键、范德华力
③维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl等物质,这些物质中属于非极性分子的化合物有_______ 。(填化学式)
(2)液氨常被用作制冷剂,若不断地升高温度,实现“液氨→氨气→氮气和氢气→氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的主要相互作用是①_______ ;②极性键;③_______ 。
(3)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应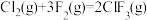 △H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为
△H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为_______ kJ/mol。ClF3的熔、沸点比BrF3的_______ (填“高”或“低”)。
(4)TiCl4稳定性比CCl4差,极易水解,试从结构分析其原因_______ 。
(5)氯丙烯分子(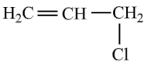 )中碳原子轨道杂化类型是
)中碳原子轨道杂化类型是_______ 。
(6)铁能与三氮唑(Bipy,结构如图)形成多种化合物。
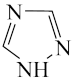
1 mol Bipy中含有σ键_______ mol。
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示

①C元素基态原子核外电子有
②维生素B1晶体溶于水的过程中要克服的微粒间的作用力有
a.离子键、共价键 b.离子键、氢键、共价键
c.氢键、范德华力 d.离子键、氢键、范德华力
③维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl等物质,这些物质中属于非极性分子的化合物有
(2)液氨常被用作制冷剂,若不断地升高温度,实现“液氨→氨气→氮气和氢气→氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的主要相互作用是①
(3)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应
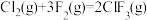 △H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为
△H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为(4)TiCl4稳定性比CCl4差,极易水解,试从结构分析其原因
(5)氯丙烯分子(
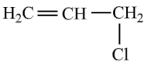 )中碳原子轨道杂化类型是
)中碳原子轨道杂化类型是(6)铁能与三氮唑(Bipy,结构如图)形成多种化合物。

1 mol Bipy中含有σ键
您最近一年使用:0次
名校
解题方法
3 . 周期表中VIA族元素及其化合物应用广泛。用硫磺熏蒸中药材的传统由来已久; 是一种易燃的有毒气体(燃烧热为
是一种易燃的有毒气体(燃烧热为 ),可制取各种硫化物;硫酸、硫酸盐是重要化工原料;硫酰氯
),可制取各种硫化物;硫酸、硫酸盐是重要化工原料;硫酰氯 是重要的化工试剂,常作氯化剂或氯磺化剂。硒
是重要的化工试剂,常作氯化剂或氯磺化剂。硒 和碲(52
和碲(52 的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收
的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收 ,以电解强碱性
,以电解强碱性 溶液制备
溶液制备 。下列说法正确的是
。下列说法正确的是
 是一种易燃的有毒气体(燃烧热为
是一种易燃的有毒气体(燃烧热为 ),可制取各种硫化物;硫酸、硫酸盐是重要化工原料;硫酰氯
),可制取各种硫化物;硫酸、硫酸盐是重要化工原料;硫酰氯 是重要的化工试剂,常作氯化剂或氯磺化剂。硒
是重要的化工试剂,常作氯化剂或氯磺化剂。硒 和碲(52
和碲(52 的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收
的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收 ,以电解强碱性
,以电解强碱性 溶液制备
溶液制备 。下列说法正确的是
。下列说法正确的是A. 、 、 都是由极性键构成的极性分子 都是由极性键构成的极性分子 |
B. 与 与 微粒中的 微粒中的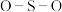 夹角都是 夹角都是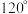 |
C.硒原子基态核外电子排布式为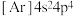 |
| D.VIA族元素氢化物的沸点从上到下依次增大 |
您最近一年使用:0次
2022-12-04更新
|
307次组卷
|
2卷引用:黑龙江省富锦市第一中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
4 . 2022年北京冬奥会已经成功落下帷幕,它的成功举办离不开各种科技力量的支撑。下列说法正确的是

| A.跨临界直接制冰使用的CO2分子中含有非极性键 |
| B.滑冰场上的冰中水分子的稳定性低于甲烷 |
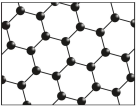
| C.颁奖礼服内胆中添加了石墨烯(结构如图),其中C原子的杂化方式是sp3杂化 |
| D.闭幕式中,鸟巢上空绽放的璀璨焰火与原子核外电子发生跃迁释放能量有关 |
您最近一年使用:0次
2022-04-23更新
|
491次组卷
|
7卷引用:黑龙江省佳木斯市第八中学2021-2022学年高二下学期期中考试化学试题
名校
5 . 下列对分子的性质的解释中,不正确的是
| A.水很稳定(1000℃以上才会部分分解),是因为水中含有大量的氢键 |
B. 分子的结构为 分子的结构为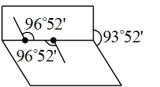 ,可知 ,可知 为极性分子 为极性分子 |
| C.“碘易溶于四氯化碳”“甲烷难溶于水”都可用相似相溶原理解释 |
D.H2O和 中心原子均为 中心原子均为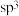 杂化,前者空间结构为 杂化,前者空间结构为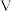 形,后者为正四面体形 形,后者为正四面体形 |
您最近一年使用:0次
2022-04-19更新
|
225次组卷
|
4卷引用:黑龙江省佳木斯市第十二中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
6 . 下列模型分别表示C2H2、S8、SF6的结构,下列说法正确的是


| A.32 g S8分子中含有0.125 mol σ键 |
| B.SF6是由非极性键构成的分子 |
| C.1 mol C2H2分子中有3 mol σ键和2 mol π键 |
| D.C2H2分子中不含非极性键 |
您最近一年使用:0次
2022-02-12更新
|
1092次组卷
|
9卷引用:黑龙江省佳木斯市第十二中学2021-2022学年高二下学期期中考试化学试题
黑龙江省佳木斯市第十二中学2021-2022学年高二下学期期中考试化学试题(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)专题3 微粒间作用力与物质性质 第三单元 共价键共价晶体 第1课时 共价键的形成及类型四川省遂宁市射洪中学2022-2023学年高二上学期第一次月考(10月)化学试题北京教育学院附属中学2022-2023学高三上学期10月测试 化学试题3.3.1共价键的形成和类型 课中山东省东营市利津县高级中学2023-2024学年高二12月月考化学试题山东省曹县博雅中学2022-2023学年高二上学期期末考试化学试题黑龙江省大庆市大庆中学2023-2024学年高二下学期开学化学试题
名校
解题方法
7 . 配位化合物物广泛的应用于物质分离、定量测定.医药、催化等方面。利用氧化法可制备某些配位化合物。如2CoCl2+2NH4Cl+8NH3+H2O2=2[Co(NH3)5Cl]Cl2+2H2O
下列说法正确的是
下列说法正确的是
| A.该配位化合物的配位数为5 |
| B.提供孤电子对的成键原子是N和Cl |
| C.[Co(NH3)5Cl]2+中存在配位键、共价键和离子键 |
| D.氧化剂H2O2是非极性分子 |
您最近一年使用:0次
2020-08-22更新
|
939次组卷
|
10卷引用:黑龙江省佳木斯市三校联考2023-2024学年高三上学期第三次调研考试化学试题
黑龙江省佳木斯市三校联考2023-2024学年高三上学期第三次调研考试化学试题山东省菏泽市东明县第一中学2019-2020学年高二期末考试化学试题海南省儋州市第二中学2020-2021学年高二下学期3月月考化学试题山东省聊城市第三中学2021-2022学年高二下学期第一次质量检测化学试题第四节 配合物与超分子湖南省邵东市第一中学2022-2023学年高二上学期第三次月考化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第三章01讲核心(已下线)第五章 物质结构与性质 元素周期律 必做实验提升(五) 简单配合物的形成与制备广东省顺德市(李兆基中学、郑裕彤中学、华侨中学)等2022-2023学年高二下学期4月期中考试化学试题辽宁省葫芦岛市绥中县第一高级中学2022-2023学年高二下学期4月监测化学试题
名校
解题方法
8 . 已知PH3与NH3结构相似,回答下列问题:
①PH3的电子式________ ,结构式________ 。
②几何构型为________ 。
③中心原子采取________ 杂化。
④PH3分子中的化学键________ (填“有”或“无”)极性,其分子为________ (填“极性”或”非极性”)分子。
⑤PH3与NH3的热稳定性:________ 更强。
①PH3的电子式
②几何构型为
③中心原子采取
④PH3分子中的化学键
⑤PH3与NH3的热稳定性:
您最近一年使用:0次
2020-03-06更新
|
316次组卷
|
2卷引用:黑龙江省桦南县第二中学2019-2020学年高二下学期期中考试化学试题
名校
9 . 下列分子中,属于易溶于水的一组是( )
| A.CH4、CCl4、CO2 | B.NH3、HCl、HBr |
| C.Cl2、H2、N2 | D.H2S、NO、SO2 |
您最近一年使用:0次
2017-12-12更新
|
158次组卷
|
5卷引用:黑龙江省桦南县第二中学2019-2020学年高二下学期期中考试化学试题



