名校
解题方法
1 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是______ ;基态Se原子的价电子运动状态有____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为_______ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为________ ,二者中更易与 形成配位键的是
形成配位键的是________ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是______ 。
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为______ ,Fe2+与O2-最短核间距为_____ pm。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是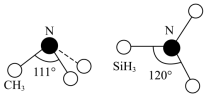
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为
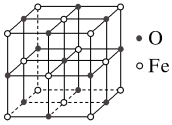
您最近一年使用:0次
名校
2 . 化学推动着社会的进步和人类的发展,下列有关说法不正确的是
| A.火箭表面涂层的成分为石墨烯,该成分是一种烯烃 |
| B.ClO2是国际上公认的安全、无毒的绿色消毒剂,可代替氯气用于自来水消毒 |
| C.月球上插着一面用芳纶纤维特制的五星红旗,芳纶纤维属于有机高分子材料 |
| D.液晶显示器是一种采用液晶为材料的显示器,液晶是介于液态和晶态之间的物质状态 |
您最近一年使用:0次
2023-04-17更新
|
531次组卷
|
3卷引用:宁夏回族自治区石嘴山市第三中学2022-2023学年高三下学期第四次模拟考试理综化学试题
名校
3 . 乙酰丙酮是一种有酯气味的无色透明液体,常用作溶剂、有机合成中间体、金属络合剂等。它有两种主要互变异构体A、B,与 、
、 、
、 、
、 、
、 等形成配合物C。回答下列有关问题:
等形成配合物C。回答下列有关问题:
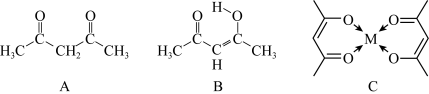
(1)基 离子的价电子排布式为
离子的价电子排布式为_______ ,Be和Mg第一电离能较大的是_______ 原子。
(2)A中碳原子杂化轨道类型有_______ ,具有分子内氢键的是_______ (填“A”或“B”)。
(3)C中 键与
键与 键数目之比为
键数目之比为_______ 。
(4)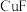 的熔点为1008℃,熔化呈液态时能导电;
的熔点为1008℃,熔化呈液态时能导电; 的熔点为326℃,能升华,熔化呈液态时不导电。由信息可知
的熔点为326℃,能升华,熔化呈液态时不导电。由信息可知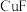 的晶体类型是
的晶体类型是_______ 晶体。
(5) 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为_______  (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、
、 、
、 、
、 、
、 等形成配合物C。回答下列有关问题:
等形成配合物C。回答下列有关问题:
(1)基
 离子的价电子排布式为
离子的价电子排布式为(2)A中碳原子杂化轨道类型有
(3)C中
 键与
键与 键数目之比为
键数目之比为(4)
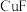 的熔点为1008℃,熔化呈液态时能导电;
的熔点为1008℃,熔化呈液态时能导电; 的熔点为326℃,能升华,熔化呈液态时不导电。由信息可知
的熔点为326℃,能升华,熔化呈液态时不导电。由信息可知 的晶体类型是
的晶体类型是(5)
 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为 (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
4 . 下列各组物质的晶体类型相同的是
| A.SiO2和SO3 | B.I2和NaCl | C.Cu和Ag | D.SiC和MgO |
您最近一年使用:0次
2021-09-07更新
|
6219次组卷
|
30卷引用:宁夏吴忠中学2021-2022学年高三上学期第一次月考化学试题
宁夏吴忠中学2021-2022学年高三上学期第一次月考化学试题2021年新高考天津化学高考真题北京首都师范大学附属中学2021-2022学年高三上学期10月月考化学试题2021年天津高考化学试题变式题1-12(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)上海市实验学校2021-2022学年高三下学期3月月考化学试题辽宁省东北育才学校2021-2022学年高三上学期( 高中部) 第三次模拟考试化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)卷01 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)天津市静海区四校2021-2022学年高三上学期12月阶段性检测化学试题(已下线)第31讲 晶体结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第38讲 晶体结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第31讲 晶体结构与性质(已下线)题型93 晶体类型的判断(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(选择题1-5)(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第6讲 晶体结构与性质(已下线)5.3.2 晶体 非晶体-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)福建省厦门集美中学2021-2022学年高二下学期第一次月考化学试题海南省东方中学2021-2022学年高二下学期第一次月考化学试题(已下线)第三单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)黑龙江省双鸭山市第一中学2021-2022学年高二下学期期末考试化学试题四川省遂宁中学校2022-2023学年高二上学期期中考试化学试题天津市和平区2022-2023学年高二下学期期末质量调查化学试题安徽省合肥市六校2022-2023学年高二下学期期末联考化学试题湖南省永州市第一中学2023-2024学年高二下学期开学考试化学试题重庆市璧山来凤中学校2023-2024学年高二下学期3月月考化学试题(已下线)专题01 物质的结构与性质-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)
5 . 在水晶柱面上滴一滴熔化的石蜡,用一根红热的铁针刺中凝固的石蜡,会发现不同方向石蜡熔化的快慢不同,这是晶体的
| A.自范性 | B.均一性 | C.晶胞“无隙并置”性 | D.各向异性 |
您最近一年使用:0次
2021-02-19更新
|
533次组卷
|
5卷引用:宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题
宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题(人教版2019)选择性必修2 第三章 晶体结构与性质 第一节 物质的聚集状态与晶体的常识2陕西省武功县普集高级中学2020-2021学年高二下学期第一次月考化学试题(已下线)3.1 物质的聚集状态与晶体的常识(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)黑龙江省鸡西市英桥高级中学2021-2022学年高二下学期期中考试化学试卷
名校
6 . 下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是
| A.SiO2和NaCl | B.NaCl和MgO |
| C.晶体Si和MgCl2 | D.金刚石和KCl |
您最近一年使用:0次
2020-11-18更新
|
227次组卷
|
2卷引用:宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题
名校
7 . 有下列几种晶体:A、无色水晶,B、冰醋酸,C、白磷,D、金刚石,E、晶体氩,F、干冰
(1)属于分子晶体的是_____________ (填序号,下同)。
(2)属于原子晶体的化合物是__________ 。
(3)直接由原子构成的晶体是____________ 。
(4)受热融化时化学键不发生变化的晶体是______ , 受热融化时需要克服共价键的晶体是______ 。
(5)晶体中存在氢键的是______________ 。
(6)晶体中不存在化学键的是______________ 。
(1)属于分子晶体的是
(2)属于原子晶体的化合物是
(3)直接由原子构成的晶体是
(4)受热融化时化学键不发生变化的晶体是
(5)晶体中存在氢键的是
(6)晶体中不存在化学键的是
您最近一年使用:0次
2017-09-21更新
|
400次组卷
|
2卷引用:宁夏石嘴山市第三中学2018届高三9月月考化学试题
名校
解题方法
8 . 【化学—选修3:物质结构与性质】
Cu、Ni、V为制造合金及合成催化剂的重要元素。
请回答:
(1)Cu元素位于元素周期表的_________ 区,其基态原子有_________ 种能量不同的电子。
(2)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为__________ (任写一种);NH3分子的VSEPR模型为_______________ 。
(3)Ni(CO)4的熔点为-25℃,沸点为43℃。其晶体类型为___________ 。晶体中σ键和π键的数目之比为_________ 。
(4)Ni可作为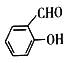 或
或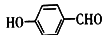 与H2加成的催化剂。在相同压强下,
与H2加成的催化剂。在相同压强下,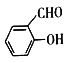 的沸点比
的沸点比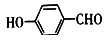 低,原因为
低,原因为_________________ 。
(5) 有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为
有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为______ (用元素符号表示);氧原子的杂化轨道类型为______________ 。
(6)已知:钇钡铜氧晶体的晶胞是一个长方体(如图所示),其晶胞参数分别为a nm、bnm,阿伏伽德罗常数的值为NA。则该晶体的密度为________ g /cm3(列出计算式即可)。
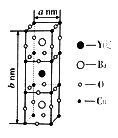
Cu、Ni、V为制造合金及合成催化剂的重要元素。
请回答:
(1)Cu元素位于元素周期表的
(2)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为
(3)Ni(CO)4的熔点为-25℃,沸点为43℃。其晶体类型为
(4)Ni可作为
 或
或 与H2加成的催化剂。在相同压强下,
与H2加成的催化剂。在相同压强下, 的沸点比
的沸点比 低,原因为
低,原因为(5)
 有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为
有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为(6)已知:钇钡铜氧晶体的晶胞是一个长方体(如图所示),其晶胞参数分别为a nm、bnm,阿伏伽德罗常数的值为NA。则该晶体的密度为

您最近一年使用:0次
2017-05-29更新
|
240次组卷
|
2卷引用:宁夏银川一中2017届高三考前适应性训练(二)化学试题
名校
9 . 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式___________ 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是___________ ;
②写出Al2Cl6分子的结构式___________ ;
③单分子A1Cl3的立体构型是___________ ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是___________ 。
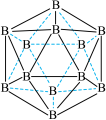
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有___________ 种不同的结构类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm−3,计算确定其晶胞的类型(简单、体心或面心立方)___________ ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=___________ pm。
(1)写出基态镓原子的电子排布式
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是
②写出Al2Cl6分子的结构式
③单分子A1Cl3的立体构型是
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有

(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm−3,计算确定其晶胞的类型(简单、体心或面心立方)
您最近一年使用:0次
2016-12-09更新
|
450次组卷
|
6卷引用:2016届宁夏回族自治区银川一中高三上第三次月考化学试卷
10 . I.S4N4的结构如图:
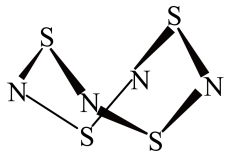
(1)S4N4的晶体类型是__________ 。
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4。化学反应方程为:6S2Cl2+16NH3= S4N4 +S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是_____ 。
a.离子键 b.极性键 c.非极性键 d.金属键 e.配位键 f.范德华力
②S2Cl2中,S原子轨道的杂化类型是_________ 。
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:

(3)基态Cu2+的最外层电子排布式为_______________ 。
(4)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是__________________ 。
(5)lmol二甘氨酸合铜(II)含有的二键数目是______ 。
(6)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是________ (填写编号)。

(1)S4N4的晶体类型是
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4。化学反应方程为:6S2Cl2+16NH3= S4N4 +S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是
a.离子键 b.极性键 c.非极性键 d.金属键 e.配位键 f.范德华力
②S2Cl2中,S原子轨道的杂化类型是
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:

(3)基态Cu2+的最外层电子排布式为
(4)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是
(5)lmol二甘氨酸合铜(II)含有的二键数目是
(6)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是
您最近一年使用:0次



