名校
1 . 下列有关说法正确的是( )
①原子晶体中只存在非极性共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④干冰升华时,分子内共价键会发生断裂
⑤晶格能由大到小顺序:NaF>NaCl>NaBr>NaI
⑥分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定越高
⑦分子晶体中分子间作用力越大,分子越稳定
①原子晶体中只存在非极性共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④干冰升华时,分子内共价键会发生断裂
⑤晶格能由大到小顺序:NaF>NaCl>NaBr>NaI
⑥分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定越高
⑦分子晶体中分子间作用力越大,分子越稳定
| A.①②③⑥ | B.①②④ | C.③⑤⑥⑦ | D.③⑤ |
您最近一年使用:0次
2019-08-06更新
|
112次组卷
|
2卷引用:辽宁省大连市大连海湾高级中学2019-2020学年高二下学期第一次质量检测化学试题
2 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____ ,有____ 个未成对电子。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________ 。
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________ 。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____ ,微粒之间存在的作用力是____ 。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为____ 。
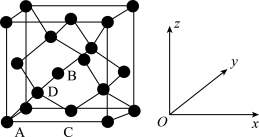
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a pm,其密度为_________ g·cm-3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为

②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a pm,其密度为
您最近一年使用:0次
3 . 碳及其化合物的用途广泛,碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质。
(1)C60分子形成的晶体中,在晶胞的顶点和面心均含有一个C60分子,则一个C60晶胞的质量为____ 。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是____ 。
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有____ 。
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b.晶体中共价键的键长:金刚石中C-C<石墨中C-C
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图所示,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为____ ,一个晶胞中N原子数目为____ 。

(5)碳与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,即在晶胞的顶点和面心均含有一个Cu原子,则Cu晶体中Cu原子的配位数为___ 。已知Cu晶体的密度为ρ g·cm-3,Cu的相对原子质量为M,阿伏加 德罗常数为NA,则Cu的原子半径为____ 。
(1)C60分子形成的晶体中,在晶胞的顶点和面心均含有一个C60分子,则一个C60晶胞的质量为
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b.晶体中共价键的键长:金刚石中C-C<石墨中C-C
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图所示,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为

(5)碳与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,即在晶胞的顶点和面心均含有一个Cu原子,则Cu晶体中Cu原子的配位数为
您最近一年使用:0次
名校
4 . 下列各组晶体物质中,化学键类型相同,晶体类型也相同的是 ( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
| A.①②③ | B.④⑤⑥ | C.③④⑥ | D.①③⑤ |
您最近一年使用:0次
2019-06-27更新
|
2393次组卷
|
47卷引用:2015-2016学年辽宁沈阳二中高二6月小班成果验收化学卷
2015-2016学年辽宁沈阳二中高二6月小班成果验收化学卷辽宁省葫芦岛市实验中学2019-2020高二下学期期中考试化学试题辽宁省渤海大学附属高级中学2021-2022学年高二下学期阶段性考试化学试题(已下线)2012-2013学年四川省南充高中高二上学期期中考试理科化学试卷2015-2016学年山西省怀仁一中高二下第三次月考化学试卷(已下线)同步君 选修3 第三章 第二节 原子晶体高中化学人教版 选修三 第3章 晶体结构与性质 原子晶体上海杨浦高级中学2017-2018学年高二上学期12月月考化学试题山西省临猗县临晋中学2017-2018学年高二下学期期末考试化学试题贵州省从江县第一民族中学2018-2019学年高二上学期期末考试化学试题【全国百强校】安徽省合肥市第六中学2018-2019学年高二下学期开学考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二下学期4月月考化学试题【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二下学期4月月考化学试题【全国百强校】贵州省思南中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年5月8日 《每日一题》选修3-原子晶体与分子晶体的比较【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期中考试化学试题安徽省亳州市第二中学2018-2019学年高二下学期5月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期第二次月考化学试题吉林省乾安县第七中学2018-2019学年高二下学期第二次质量检测化学试题广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题吉林省吉林市第三中学2018-2019学年高二5月阶段测试化学试题山西省应县第一中学校2018-2019学年高二下学期期中考试化学试题内蒙古包头市第四中学2018-2019学年高二下学期第一次月考(3月)化学试题云南省昭通市永善县第二中学2019—2020学年高二上学期期末考试化学试题第3章 物质的聚集状态与物质性质 易错疑难集训(二)——A学习区 夯实基础(鲁科版选修3)河北省邯郸市馆陶县第一中学2019-2020学年高一下学期期中考试化学试卷山西省太原市阳曲县第一中学2019-2020学年高二5月复学检测化学试题吉林省长春市第二十九中学2019-2020学年高二下学期期中考试化学试题陕西省西安市西安高新第一中学2018-2019学年高二下学期期末考试化学试题宁夏大学附属中学2020-2021学年高二上学期期中考试化学试题天津市滨海新区汉沽第六中学2021届高三上学期第一次月考化学试题新疆哈密市第八中学2019-2020学年高二下学期期末考试化学试题(鲁科版2019)选择性必修2 第3章 不同聚集状态的物质与性质 章末综合检测卷(人教版2019)选择性必修2 第三章 晶体结构与性质 第二节 分子晶体与共价晶体 易错疑难集训(二)鲁科版2019选择性必修2第3章综合检测卷(人教版2019)选择性必修2 第三章 晶体结构与性质 综合检测卷高二选择性必修2(人教版2019)第三章 晶体结构与性质 第三章素养检测吉林省松原市实验高级中学2020-2021学年高二下学期第一次月考化学(A)试题山东省枣庄市第八中学东校2020-2021学年高二4月月考化学试题河北省衡水市武强中学2020-2021学年高二下学期第一次月考化学试题(已下线)3.2 分子晶体与共价晶体(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)天津市第四十三中学2020-2021学年高一下学期期末考试化学试题浙江省杭州市西湖高级中学2021-2022学年高二下学期期中考试化学试题 专题3 微粒间作用力与物质性质 本专题复习提升四川省安岳县兴隆中学2021-2022学年高二上学期期中测试化学试题新疆阿克苏市实验中学2022-2023学年高二下学期第三次月考化学试题山东省鄄城县第一中学2023-2024学年高二下学期3月月考化学试题
5 . (1)Fe(CO)5中铁的化合价为0,写出铁原子的简化的基态电子排布式______ ,Fe在周期表中第______ 周期______ 族,属于_______ 区。
(2)已知Fe(CO)5常温下呈液态,熔点为﹣20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体为________ (填晶体类型)。
(3)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。

体心立方晶胞和面心立方晶胞中实际含有的铁原子个数之比为________ ;Fe原子配位数之比为____ 。若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞密度之比为_______ 。
(4)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如图所示(黑点代表铜原子,空心圆代表Y原子)。
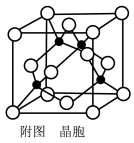
①该晶体的化学式为________ 。(用元素符号表示)
②已知该晶体的密度为ρ g/cm3,阿伏加 德罗常数为NA,则该晶胞边长为______ nm(只写计算式)。
(2)已知Fe(CO)5常温下呈液态,熔点为﹣20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体为
(3)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。

体心立方晶胞和面心立方晶胞中实际含有的铁原子个数之比为
(4)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如图所示(黑点代表铜原子,空心圆代表Y原子)。

①该晶体的化学式为
②已知该晶体的密度为ρ g/cm3,阿伏加 德罗常数为NA,则该晶胞边长为
您最近一年使用:0次
6 . 下列化学式能真实表示物质分子组成的是
| A.SO3 | B.SiO2 | C.KCl | D.NaOH |
您最近一年使用:0次
7 . 下列说法不正确的是( )
| A.下列物质的熔沸点排列:晶体硅<碳化硅<金刚石 |
| B.石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 |
| C.氢键、分子间作用力、离子键、共价键等都是微粒间的作用力,其中只有离子键和共价键是化学键 |
| D.黄色晶体碳化铝,熔点2 200℃,熔融态不导电,是原子晶体 |
您最近一年使用:0次
8 . 第二周期元素A和B能形成键角为180°的AB2气体分子,则下列推断正确的是( )
| A.AB2分子的空间构型为直线形 |
| B.AB2分子为极性分子 |
| C.熔点、沸点:AB2>H2O |
| D.AB2与SiO2的结构相同 |
您最近一年使用:0次
2019-06-07更新
|
225次组卷
|
2卷引用:辽宁省瓦房店市高级中学2018-2019学年高二下学期期中考试化学试题
9 . 下列说法中正确的是( )
| A.NCl3、PCl5、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 |
| B.1mol SiO2 中含有2molSi-O键 |
| C.干冰晶体中与每个CO2距离相等且最近的CO2共有12个 |
| D.原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度 |
您最近一年使用:0次
2019-06-07更新
|
103次组卷
|
2卷引用:辽宁省瓦房店市高级中学2018-2019学年高二下学期期中考试化学试题
10 . 硅酸盐与二氧化硅一样,都以硅氧四面体作为基本结构单元。硅氧四面体可以表示成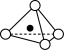 ,其中○表示氧原子,黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成不同的多聚硅酸根离子。如图所示为某无限长单键的多聚硅酸根离子的结构,试确定该阴离子中硅原子与氧原子的个数之比为
,其中○表示氧原子,黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成不同的多聚硅酸根离子。如图所示为某无限长单键的多聚硅酸根离子的结构,试确定该阴离子中硅原子与氧原子的个数之比为
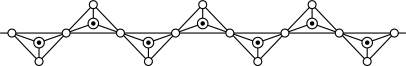
 ,其中○表示氧原子,黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成不同的多聚硅酸根离子。如图所示为某无限长单键的多聚硅酸根离子的结构,试确定该阴离子中硅原子与氧原子的个数之比为
,其中○表示氧原子,黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成不同的多聚硅酸根离子。如图所示为某无限长单键的多聚硅酸根离子的结构,试确定该阴离子中硅原子与氧原子的个数之比为
| A.1∶2 | B.1∶3 | C.1∶4 | D.2∶5 |
您最近一年使用:0次
2019-04-25更新
|
820次组卷
|
13卷引用:辽宁省凌源市第二高级中学2019-2020学年高二第四次网上测试化学试题
辽宁省凌源市第二高级中学2019-2020学年高二第四次网上测试化学试题(已下线)2011届四川省南充高中高三第七次月考化学卷山西省运城市新绛县第二中学2018-2019学年高二下学期期中考试化学试题第3章 物质的聚集状态与物质性质——B拓展区综合拓展(鲁科版选修3)天津市第一中学2021届高三上学期第二次月考化学试题(人教版2019)选择性必修2 第三章 晶体结构与性质 第三节 金属晶体与离子晶体 课时3 过渡晶体与混合型晶体(人教版2019)选择性必修2 第三章 晶体结构与性质 第三节 金属晶体与离子晶体 第2课时 离子晶体过渡晶体与混合型晶体鲁科版2019选择性必修2第3章 不同聚集状态的物质与性质 第2节 几种简单的晶体结构模型 第4课时 分子晶体晶体结构的复杂性宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试卷广东省深圳市盐田高级中学2021-2022学年高二下学期4月考试化学试题(已下线)第6讲 晶体结构与性质河北昌秦皇岛市昌黎第一中学2023-2024学年高二上学期第五次调研考试化学试题山东省鄄城县第一中学2023-2024学年高二下学期3月月考化学试题



