1 . 下列说法不正确的是
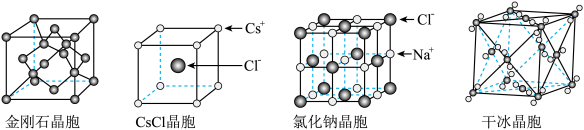
| A.金刚石晶体为网状结构,由共价键形成的碳环中,最小的环上有6个碳原子 |
B.氯化铯晶体中,每个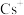 周围紧邻8个 周围紧邻8个 |
C.氯化钠晶体中,每个 周围紧邻且距离相等的 周围紧邻且距离相等的 共有6个 共有6个 |
D.干冰晶体中,每个 分子中碳原子采取 分子中碳原子采取 杂化 杂化 |
您最近半年使用:0次
2024-02-14更新
|
864次组卷
|
5卷引用:江西省南昌市第十中学2023-2024学年高二下学期第一次月考化学试卷
江西省南昌市第十中学2023-2024学年高二下学期第一次月考化学试卷湖南省长沙市长郡中学2023-2024学年高二上学期期末考试化学试题(已下线)3.3.2过渡晶体与混合型晶体、晶体类型的比较-随堂练习(已下线)3.3.1 金属晶体 离子晶体(提高)天津市滨海新区塘沽一中2023-2024学年高二下学期第一次月考化学试卷
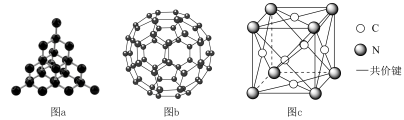
2 . 碳有金刚石(晶体模型如图a)、 (分子结构如图b,每个分子内有32个面,均为正五边形或正六边形)等单质,碳能形成甲醛、
(分子结构如图b,每个分子内有32个面,均为正五边形或正六边形)等单质,碳能形成甲醛、 氮化碳(分子结构如图c,分子内N和C均达到
氮化碳(分子结构如图c,分子内N和C均达到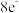 稳定结构)等化合物,下列说法
稳定结构)等化合物,下列说法不正确 的是
 (分子结构如图b,每个分子内有32个面,均为正五边形或正六边形)等单质,碳能形成甲醛、
(分子结构如图b,每个分子内有32个面,均为正五边形或正六边形)等单质,碳能形成甲醛、 氮化碳(分子结构如图c,分子内N和C均达到
氮化碳(分子结构如图c,分子内N和C均达到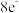 稳定结构)等化合物,下列说法
稳定结构)等化合物,下列说法
A.金刚石结构中最小环是六元环,平均每个六元环有0.5个C,1条 |
B. 氮化碳的分子式为 氮化碳的分子式为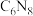 |
C.甲醛中C为 杂化 杂化 |
D. 分子中有16个五元环和16个六元环 分子中有16个五元环和16个六元环 |
您最近半年使用:0次
3 . 第三周期元素的单质熔点如图所示。下列叙述正确的是


| A.图中涉及了四种晶体类型 | B. 熔点低于 熔点低于 的原因是P-P键键能较小 的原因是P-P键键能较小 |
| C.硅晶体由非极性键形成空间网状结构 | D.金属越活泼,其单质熔点越高 |
您最近半年使用:0次
4 . 磷有多种同素异形体,其中白磷和黑磷(每一个层由曲折的磷原子链组成)的结构如图所示,设 为阿伏加德罗常数的值。下列说法中不正确的是
为阿伏加德罗常数的值。下列说法中不正确的是
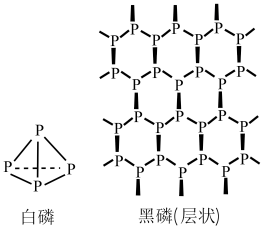
 为阿伏加德罗常数的值。下列说法中不正确的是
为阿伏加德罗常数的值。下列说法中不正确的是
A.3.1g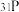 中含有的质子数为1.5 中含有的质子数为1.5 |
B.31g白磷与31g黑磷中含有的P—P键数目均为1.5 |
C.12.4g白磷与0.6mol 在密闭容器中充分反应,生成的 在密闭容器中充分反应,生成的 分子数为0.4 分子数为0.4 |
D.0.11mol白磷发生反应: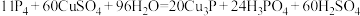 ,转移的电子数为1.2 ,转移的电子数为1.2 |
您最近半年使用:0次
2023-06-26更新
|
399次组卷
|
2卷引用:江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题
5 . 我国科学家预言的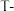 碳已被合成。
碳已被合成。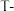 碳的晶体结构可看作将金刚石中的碳原子用由四个碳原子组成的正四面体结构单元取代所得,金刚石和
碳的晶体结构可看作将金刚石中的碳原子用由四个碳原子组成的正四面体结构单元取代所得,金刚石和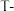 碳的晶胞如图所示。下列说法正确的是
碳的晶胞如图所示。下列说法正确的是
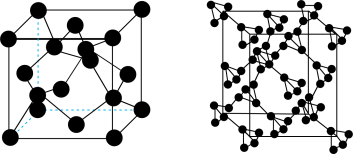
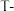 碳已被合成。
碳已被合成。 碳的晶体结构可看作将金刚石中的碳原子用由四个碳原子组成的正四面体结构单元取代所得,金刚石和
碳的晶体结构可看作将金刚石中的碳原子用由四个碳原子组成的正四面体结构单元取代所得,金刚石和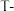 碳的晶胞如图所示。下列说法正确的是
碳的晶胞如图所示。下列说法正确的是
| A.金刚石中每个碳原子被12个最小环共用 | B.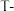 碳中最小环由24个碳原子组成 碳中最小环由24个碳原子组成 |
C.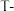 碳属于分子晶体 碳属于分子晶体 | D.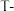 碳中键角是 碳中键角是 |
您最近半年使用:0次
2023-06-01更新
|
289次组卷
|
2卷引用:江西省宜春市上高中学2022-2023学年高二下学期7月期末考试化学试题
名校
解题方法
6 . 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应得到BF3和BN,如图所示。下列叙述正确的是
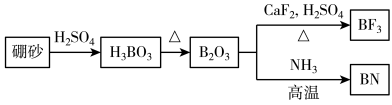
| A.硼酸具有片层状结构,层与层之间、H3BO3单元间都仅以范德华力连接 |
| B. NH3与BF3都是由极性键构成的极性分子 |
C. 与HF反应后再用氨气中和得到 与HF反应后再用氨气中和得到 ,1 mol ,1 mol 含有配位键的数目为 含有配位键的数目为 |
| D.立方氮化硼结构与金刚石相似,立方氮化硼晶胞中每个氮原子周围有4个硼原子 |
您最近半年使用:0次
2023-05-13更新
|
206次组卷
|
3卷引用:江西省南昌市第一中学2023-2024学年高二下学期4月期中考试化学试题
7 . 如图为几种晶体或晶胞的结构示意图。
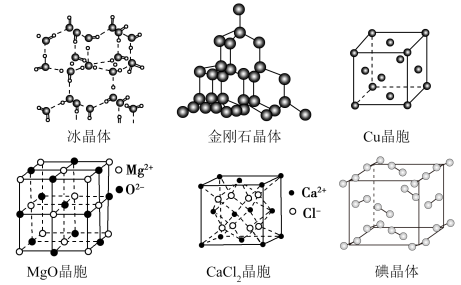
请回答下列问题:
(1)金刚石属于___________ 晶体,其中每个碳原子与___________ 个碳原子距离最近且相等;
(2)碘晶体属于___________ 晶体,每个碘晶胞中实际占有___________ 个碘分子。
(3)冰、金刚石、碘单质三种晶体的熔点由高到低的顺序为___________ 。
(4)假设碘晶胞中立方体的边长为acm,阿伏加德罗常数的值为 ,则碘晶体的密度为
,则碘晶体的密度为___________  。
。

请回答下列问题:
(1)金刚石属于
(2)碘晶体属于
(3)冰、金刚石、碘单质三种晶体的熔点由高到低的顺序为
(4)假设碘晶胞中立方体的边长为acm,阿伏加德罗常数的值为
 ,则碘晶体的密度为
,则碘晶体的密度为 。
。
您最近半年使用:0次
8 . A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如表①所示,只有E元素的单质能与水反应生成两种酸,甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素:W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②所示。
表①
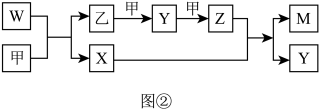
请回答下列问题:
(1)Z的化学式为___________ ;X分子的空间构型为___________ 。
(2)E的单质与水反应的离子方程式为___________ 。 D、E元素可分别与硅(Si)、钛(Ti)元素形成化合物,其中SiD2的熔点为1723℃,沸点2230℃,TiE4的熔点为-24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是___________ 。
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为___________ 。
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为___________ ,该温度下的平衡常数为___________ 。
表①
| B | D | |
| E |

请回答下列问题:
(1)Z的化学式为
(2)E的单质与水反应的离子方程式为
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为
您最近半年使用:0次
解题方法
9 . 短周期元素X、Y、Z、W中,X元素的原子最外层电子排布为ns1,Y元素的原子价电子排布为ns2np2,Z元素的最外层电子数是其电子层数的3倍,W元素原子的M电子层的p能级中有3个未成对电子。
(1)Z原子的电子排布式为___________ ,若X为非金属元素,则按原子轨道的重叠方式,X与Z形成的化合物中的共价键属于___________ 键(填“σ”或“π”)。
(2)当n=2时,Y在元素周期表的位置为___________ ,YZ2属于___________ 分子(填“极性”或“非极性”)。
(3)当n=3时,YZ2晶体属于___________ 晶体;YZ2晶体中Y原子与Y-Z键的数目之比为___________ 。
(4)若X元素的原子最外层电子排布为2s1,Y元素的原子价电子排布为3s23p2,X、Y、Z、W四种元素的第一电离能由大到小的顺序是___________ (用元素符号表示)。
(1)Z原子的电子排布式为
(2)当n=2时,Y在元素周期表的位置为
(3)当n=3时,YZ2晶体属于
(4)若X元素的原子最外层电子排布为2s1,Y元素的原子价电子排布为3s23p2,X、Y、Z、W四种元素的第一电离能由大到小的顺序是
您最近半年使用:0次
10 . 下列关于 和金刚石的叙述正确的是
和金刚石的叙述正确的是
 和金刚石的叙述正确的是
和金刚石的叙述正确的是A. 是共价晶体,它是自然界含量最高的固态二元化合物 是共价晶体,它是自然界含量最高的固态二元化合物 |
B.通常状况下,1mol 晶体中含有 晶体中含有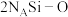 键( 键( 表示阿伏加德罗常数值) 表示阿伏加德罗常数值) |
| C.金刚石的网状结构中,由共价键形成的最小环上有6个碳原子,1个碳原子被6个六元环所共用 |
D.1mol金刚石中含有 个C-C键( 个C-C键( 表示阿伏加德罗常数的值) 表示阿伏加德罗常数的值) |
您最近半年使用:0次
2023-03-30更新
|
238次组卷
|
3卷引用:江西省南昌市第十九中学2022-2023学年高二下学期期中考试化学试卷



